tirto.id - Ikatan logam merupakan ikatan yang terbentuk karena adanya gaya tarik inti atom-atom logam dengan lautan elektron. Agar semakin paham tentang ikatan logam, berikut ini pembahasan mengenai ikatan logam, mulai dari pengertian, ciri-ciri, sifat, hingga proses pembentukan ikatan logam.
Atom logam memiliki keelektronegatifan yang rendah, yang berarti mereka cenderung dengan mudah melepaskan elektron terluarnya. Ketika atom logam melepaskan electron dapat menghasilkan kation atau ion positif.
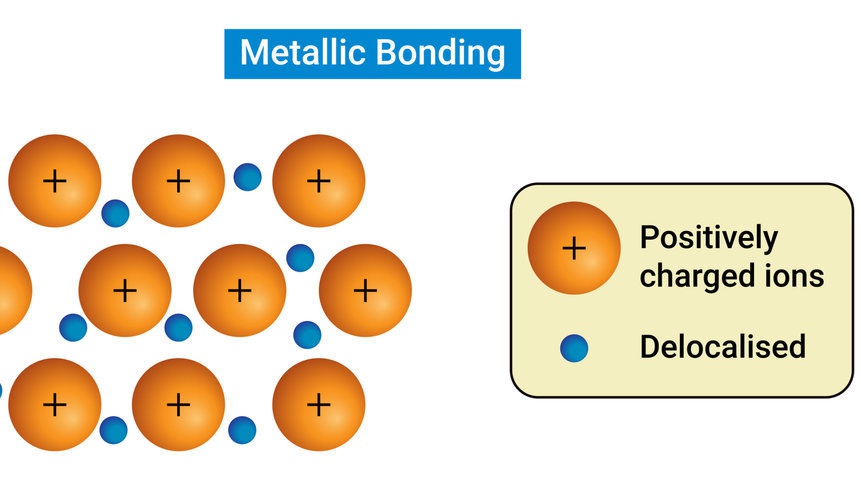
Elektron-elektron dari atom logam tersebar di dalam kisi-kisi logam dan dapat bergerak bebas di antara semua kation, membentuk suatu lautan elektron.
Gaya elektrostatik antara muatan positif dari logam dan muatan negatif dari elektron akan menyatukan kisi-kisi logam tersebut.
Tarik-menarik yang terjadi antara kation dalam lautan elektron, berfungsi sebagai perekat yang menggabungkan kation-kation tersebut, dan fenomena ini dikenal sebagai ikatan logam.
Contoh Ikatan Logam
Ikatan logam terjadi pada semua unsur logam misalnya:
- logam natrium (Na)
- magnesium (Mg)
- alumunium (Al)
- seng (Zn)
- kadmium (Cd)
- galium (Ga)
- besi (Fe)
- emas (Au)
- kalium (K)
- mangan (Mn)
- kromium (Cr)
- barium (Ba)
- perak (Ag)
- nikel (Ni).
Sifat-sifat Ikatan Logam
Logam atau metal memiliki beberapa karakter umum yaitu wujud padat, menunjukkan kilap, massa jenis tinggi, titik didih dan titik lebur tinggi, konduktor panas dan listrik yang baik, kuat atau keras namun mudah dibentuk misalnya dapat ditempa (malleable) dan direnggangkan (ductile).
Konduktor Listrik yang baik
Ductility Tinggi
Titik lebur dan Titik didih tinggi
Keras
Ciri-ciri Spesifik Ikatan Logam
Ikatan logam memiliki beberapa ciri-ciri spesifik yang membedakannya dari jenis ikatan kimia lainnya. Berikut adalah ciri-ciri khas ikatan logam:
Lautan Elektron
Kation positif
Gaya Elektrostatik Tarik Menarik
Konduktivitas Listrik dan Termal
Proses Pembentukan Ikatan Logam
Logam memiliki sedikit elektron valensi dan tingka elektronegativitas yang rendah. Semua jenis logam cenderung memiliki sifat untuk melepaskan elektron terluarnya, menghasilkan ion positif, atom positif, atau kation logam.
Kulit terluar unsur logam relatif longgar, menciptakan ruang kosong di dalamnya. Sebagai hasilnya, elektron terdelokalisasi, di mana elektron valensi tidak terpaku pada satu atom tetapi berpindah-pindah di antara atom lain.
Pada logam, elektron-elektron yang membentuk ikatan antar atom logam bukanlah milik sepasang atom saja, melainkan bersifat kolektif untuk semua atom logam. Ikatan tersebutlah yang memungkinkan elektron-elektron bergerak bebas.
Elektron valensi logam berputar dengan kecepatan tinggi mengelilingi inti atom dan bercampur dengan elektron valensi lainnya dalam ikatan logam.
Hal ini menciptakan struktur yang menyerupai "awan" atau "lautan" yang melingkupi ion positif di dalamnya.
Elektron bebas dalam orbit ini berfungsi sebagai perekat atau lem, menghubungkan kation logam yang berdekatan. Mereka saling tarik-menarik dengan bantuan elektron bebas sebagai "lem".
Struktur logam dapat dibayangkan sebagai ion positif yang dikelilingi oleh "lautan" elektron valensi. Ion positif berada di tengah "lautan" elektron yang bergerak bebas, menyebabkan tarik-menarik antara ion positif dan elektron-elektron tersebut.
Penulis: Ruhma Syifwatul Jinan
Editor: Dhita Koesno
 Masuk tirto.id
Masuk tirto.id