tirto.id - Air merupakan zat yang rumus kimianya adalah H2O. Air dapat menjadi pelarut dari berbagai macam zat termasuk untuk menjadi pelarut pada asam dan basa.
Jika air diberi tambahan larutan asam atau larutan basa, maka kesetimbangan air akan berubah sesuai dengan jumlah asam atau basa yang ditambahkan demikian merujuk laman Repository Kemdikbud.
Adanya tambahan larutan asam atau basa pada air, maka menyebabkan larutan bersifat asam atau basa, dengan kekuatan asam basa yang bergantung pada perbandingan lebih banyak atau sedikitnya asam atau basa dengan konsentrasi ion H+ atau OH-.
Ada rumus tertentu untuk menghitung konsentrasi ion H+ atau OH- untuk asam kuat, asam lemah, basa kuat ataupun basa lemah.
Selain konsentrasi ion H+ dan OH-, konsentrasi asam basa juga dapat dinyatakan dalam derajat keasaman atau pH. Jika pH netral maka angkanya adalah 7, sedang makin tinggi angka maka makin bersifat basa.
Rumus Tetapan Kesetimbangan Air
Mengutip dari modul Interaksi Alam Basa dan Kehidupan (2018) Kemdikbud, sebagai pelarut yang mampu melarutkan banyak macam zat, air memiliki sifat elektrolit yang lemah. Molekul air mudah terionisasi dari H2O menjadi: ion H+ dan OH- Dengan reaksi kimia seperti berikut ini:
H2O (l) ⇌ H+ + OH-
Jika air dalam kondisi setimbang, maka kesetimbangan air (dilambangkan dengan Kw) dirumuskan sebagai berikut ini:
Kw = [H+] [OH-] : [H2O]
K [H2O] = [H+] x [OH-]
Dalam air murni atau dalam larutan encer, konsentrasi H2O dapat dianggap tetap sehingga H2O dapat digabung dengan tetapan kesetimbangan K [H2O] dan disebut Kw (tetapan hasil ion = tetapan ionisasi).
Kw= [H+] [OH-]
Dalam air murni [H+] = [OH-]
Ketetapan kesetimbangan air dipengaruhi oleh suhu air. Berikut ini nilai Kw pada suhu tertentu yang sudah ditetapkan:
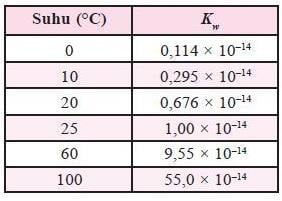
- Suhu 0 derajat celcius nilai Kw = 0,114 X 10 (pangkat -14)
- Suhu 10 derajat celcius nilai Kw = 0,295 X 10 (pangkat -14)
- Suhu 20 derajat celcius nilai Kw = 0,676 X 10 (pangkat -14)
- Suhu 25 derajat celcius nilai Kw = 1,00 X 10 (pangkat -14)
- Suhu 60 derajat celcius nilai Kw = 9,55 X 10 (pangkat -14)
- Suhu 100 derajat celcius nilai Kw = 55,0 X 10 (pangkat -14)
Jika nilai Kw dari air murni pada suhu 25 derajat C adalah Kw = 1×10 (pangkat -14).
Jadi kesetimbangannya adalah:
1×10(pangkat-14) =[H+]2
[H+] = √10-14
[H+] = 10-7 M
[OH-] = 10-7M
Pengaruh Asam dan Basa pada Kesetimbangan Air
Berikut ini adalah pengaruh asam dan basa pada kesetimbangan air:
a. Asam
Dari teori pergeseran kesetimbangan yang sudah dijelaskan dengan rumus di atas, maka penambahan ion H+ pada larutan asam akan membuat nilai H+ pada larutan juga bertambah namun tidak akan mengubah kesetimbangan (Kw).
Hanya saja, kesetimbangan akan bergeser ke kiri sehingga (OH-) menjadi lebih kecil atau ditulis:
[H+] > [OH-] dalam larutan asam.
b. Basa
Jika larutan basa ditambahkan ion OH- maka jumlah (OH-) pada larutan tersebut akan makin bertambah namun tidak berpengaruh pada nilai Kw atau hasil kali [H+] dan [OH-].
Kesetimbangan akan bergeser ke kiri sedangkan nilai [H+] mengecil. Atau ditulis:
[H+] < [OH-] dalam larutan basa.
Penulis: Cicik Novita
Editor: Maria Ulfa
 Masuk tirto.id
Masuk tirto.id




























