tirto.id - Dalam sebuah materi, dapat mengandung berbagai patikel kecil. Penyusun partikel tersebut bisa berwujud atom, ion, dan molekul.
Setiap zat yang berbeda mengandung komposisi partikel terkecil yang berbeda pula. Misalnya, logam besi
disusun oleh partikel-partikel terkecil yang berbeda dengan partikel-partikel terkecil yang menyusun kalsium.
Contoh lainnya, air mengandung partikel-partikel terkecil yang berbeda dengan partikel-partikel terkecil yang menyusun garam dapur.
Berikut ini adalah penjelasan untuk partikel-partikel pembentuk zat, yaitu atom, ion dan molekul.
Atom
Atom merupakan penyusun materi yang menjadi partikel paling terkecil. Partikel atom sudah tidak bisa dipecah lagi menjadi dua bagian atau lebih. Hal ini sesuai namanya "atomos" dari bahasa Yunani yang bermakna "tidak terbagi".
Melansir kanal Youtube Televisi Edukasi, atom memiliki partikel subatomik yang terdiri dari elektron, proton, dan neutron. Neutron merupakan partikel sub-atomik netral yang tidak bermuatan. Sementara itu, elektron memiliki muatan negatif dan pronton bermuatan positif.
Begitu kecilnya atom, mata manusia tidak mampu melihat atom. Bahkan, atom juga tidak mampu teraba oleh alat secanggih apa apun. Hingga kini, bentuk pasti dari atom belum dapat diketahui.
John Dalton (1766 - 1844), guru kimia di atas Inggris, memberikan pemikirannya terkait dengan atom pada tahun 1808. Melansir buku Belajar IPA 2 Kelas VIII (Depdiknas 2009), model atom Dalton menyatakan sebagai berikut:
- Setiap unsur terdiri dari partikel-partikel terkecil yang tidak bisa dibagi-bagi lagi, dinamakan atom.
- Semua atom dari unsur yang sama, mempunyai ukuran dan massa yang sama pula. Atom-atom dari unsur berbeda, juga mempunyai massa berbeda pula. Berangkat dari pendapat ini, maka beragamnya atom sama dengan beragamnya unsur atom.
- Atom-atom tidak bisa dirusak, dimusnahkan, atau diciptakan melalui reaksi kimia.
- Melalui reaksi kimia, atom-atom dari pereaksi akan mempunyai susunan baru dan saling terikat satu dengan lainnya dengan rasio atau perbandingan bilangan tertentu.
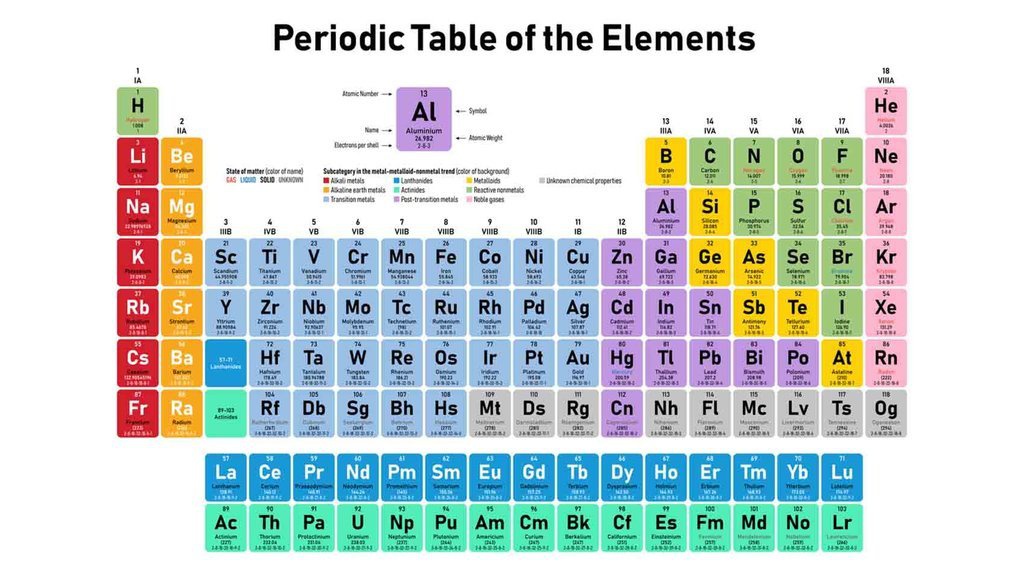
Dalam mempermudah mempelajari unsur atom dan senyawanya, para ahli kimia menyusun sistem periodik unsur.
Sistem periodik unsur adalah tabel berisi daftar semua unsur yang telah dikenal atau diketahui keberadaannya. Sekitar 118 unsur yang telah diidentifikasi saat ini baik dari golongan logam atau nonlogam.
Contoh atom dari unsur logam adalah natrium, kalsium (Ca), tembaga (Cu), dan besi (Fe). Sementara atom dari unsur nonlogam seperi helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Ra).
Ion
Ion masih berkaitan erat dengan atom. Dalam penelitian John Dalton di abad 19, ditemukan partikel ion yang merupakan zat tapi bukan disusun oleh atom melainkan partikel-partikel bermuatan. Ukuran partikel ion setara dengan atom mau pun molekul.
Ion terbentuk dari atom atau gugus atom namun berada dalam dua keadaan, antara kehilangan elektron atau mendapatkan elektron.
Atom atau gugus atom yang kehilangan sejumlah elektronnya membentuk ion positif. Sebaliknya, Atom atau gugus atom yang bertambah elektronnya membentuk ion positif.
Dalam keadaan netral, atom memiliki muatan positif dan negatif yang berjumlah sama. Atom berupa menjadi ion ketika menerima atau melepaskan elektron dalam sebuah reaksi kimia.
Contoh dari ion positif adalah NA+ dan ion negatif yaitu Cl-. Ion yang terdiri dari satu atom saja seperti contoh tersebut, dinamakan ion monoatomik. Apabila ion dibentuk melalui beberapa unsur atom dinamakan ion poliatomik seperti H3O+ atau OH-.
Molekul
Molekul adalah gabungan dua atom atau lebih unsur. Gabungan atom tersebut bisa saja dari unsur yang sama atau berbeda. Jika bergabung unsur yang sama disebut molekul unsur, dan jika bergabung unsur berbeda dinamakan molekul senyawa.
Contoh dari molekul unsur adalah gas oksigen. Pada oksigen, bergabung dua unsur yang sama yakni atom oksigen (O). Ketika dua unsur bergabung membentuk molekul dengan rumus kimia O2.
Molekul senyawa dapat dilihat pada gas karbondioksida. Gas ini tersusun dari gabungan satu unsur atom karbon (C) dan dua unsur atom oksigen (O2).
Ketika keduanya bergabung dan membentuk molekul senyawa, maka menjadi karbondioksida dengan rumus kimia CO2.
Sewaktu unsur-unsur atom bergabung dalam sebuah reaksi kimia dan membentuk molekul, jumlah atom pada suatu reaksi akan tetap. Ini sesuai Hukum Kekekalan Massa yang menyatakan massa zat-zat yang bereaksi sama dengan jumlah massa zat-zat hasil reaksi.
Contoh benda yang merupakan molekul adalah air (H2O), gula putih (C12H22O11), etanol (C2H5OH), dan sebagainya.
Penulis: Ilham Choirul Anwar
Editor: Maria Ulfa
 Masuk tirto.id
Masuk tirto.id