tirto.id - Contoh soal PAS Kimia kelas 10 semester 1 Kurikulum Merdeka dapat digunakan sebagai bahan latihan sebelum ujian. Selain itu, contoh soal UAS Kimia kelas 10 semester 1 bisa dimanfaatkan guru sebagai referensi dalam membuat soal ujian akhir semester.
Kimia kelas 10 Kurikulum Merdeka semester 1 mencakup 3 bab pokok pembahasan meliputi struktur atom dan sistem periodik unsur, ikatan kimia, dan stoikiometri. Untuk materi atom berupa perkembangan model atom dari masa ke masa juga memaparkan partikel-partikel dasar penyusunan atom serta percobaan penemuannya.
Adapun materi-materi tersebut dapat dipelajari dan diperdalam dengan berlatih soal-soal UAS Kimia kelas 10 semester 1. Melalui kegiatan mengerjakan latihan soal PAS Kimia kelas 10 semester 1, siswa diharapkan memperoleh nilai yang bagus untuk ujian akhir semester pertama mereka di SMA.
Contoh Soal PAS Kimia Kelas 10 Semester 1 Kurikulum Merdeka dan Jawabannya
Soal-soal UAS Kimia kelas 10 semester 1 yang akan diujikan umumnya hadir dalam pilihan ganda maupun esai. Berikut kumpulan latihan soal PAS Kimia kelas 10 semester 1 Kurikulum Merdeka pilihan ganda dan esai beserta jawabannya:
Latihan Soal PAS Kimia kelas 10 semester 1 Pilihan Ganda
1. Dalam bidang industri, ilmu kimia dapat membantu mempelajari sifat dan komposisi logam yang baik untuk pembuatan mesin, serta mempelajari sifat dan komposisi bahan bakar dan minyak pelumas mesin. Contoh tersebut merupakan peran ilmu kimia di bidang....
- A. Teknik sipil
- B. Mesin industri
- C. Industri perminyakan
- D. Geologi
- E. Lingkungan
Jawaban: B
2. Pernyataan yang tepat tentang tabel periodik unsur Mendeleyev adalah....
- A. Pengelompokkan unsur didasarkan pada kenaikan nomor atom unsur
- B. Unsur-unsur yang berada pada golongan yang sama memiliki kemiripan sifat
- C. Penyusunan golongan berdasarkan massa atom relatif unsur
- D. Sistem periodik unsur Mendeleyev terisi penuh dengan semua unsur yang sudah dikenal
- E. Unsur dalam satu golongan ke bawah disusun berdasarkan kenaikan nomor atom
Jawaban: B
3. Penyakit kanker merupakan jenis penyakit yang mematikan. Cabang ilmu kimia yang mempelajari cara penanganan dan pemanfaatan zat-zat radioaktif untuk mengobati penyakit kanker adalah....
- A. Biokimia
- B. Kimia farmasi
- C. Kimia organik
- D. Kimia inti
- E. Kimia fisika
Jawaban: D
4. Ari terkena sengatan lebah. Sebagai pertolongan pertama, Nasrul mengoleskan baking soda yang bersifat basa lemah pada kulit yang terkena sengatan lebah tersebut. Nasrul memberikan pertolongan pertama tersebut karena berpikir bahwa….
- A. baking soda dapat mencegah infeksi akibat sengatan lebah
- B. sengatan lebah perlu dibersihkan dengan baking soda
- C. sengatan lebah bersifat asam lemah dan akan dinetralkan dengan baking soda
- D. baking soda memiliki prinsip kerja yang sama dengan antiseptik untuk mengobati luka
- E. baking soda merupakan bahan alami yang terdapat di sekitar tempat kejadian
Jawaban: C
5. Nyka mencampurkan dua zat kimia. Di antara pernyataan di bawah ini, yang tidak menunjukkan terjadi reaksi kimia dari pencampuran dua zat adalah.…
- A. Timbul gas
- B. Terbentuk endapan
- C. Perubahan massa
- D. Perubahan warna
- E. Perubahan suhu
Jawaban: C
6. Elektron bergerak dalam lintasannya dengan tingkat energi tertentu tanpa menyerap atau membebaskan energi. Hal ini dikemukakan oleh....
- A. Dalton
- B. Rutherford
- C. Thomson
- D. Max Plack
- E. Niels Bohr
Jawaban: E
7. Annisa ingin membuat larutan KCl dengan konsentrasi tertentu. Alat- alat yang dibutuhkan Annisa antara lain….
- A. Pipet tetes, gelas ukur, tabung reaksi, spatula, dan kaca arloji
- B. Pipet volume, spatula, gelas beaker, neraca, tabung reaksi, dan rak tabung
- C. Neraca, tabung reaksi, gelas ukur, kaca arloji, spatula dan pipet tetes
- D. Tabung reaksi, neraca, gelas ukur, kaca arloji, spatula dan pipet tetes
- E. Spatula, gelas beaker, neraca, kaca arloji, labu ukur, dan pipet tetes
Jawaban: E
8. Pernyataan bahwa elektron akan menempati subkulit yang energinya paling rendah, kemudian pengisian bertahap ke tingkat energi yang lebih tinggi merupakan prinsip dari aturan….
- A. Aufbau
- B. Pauli
- C. Schrodinger
- D. Hund
- E. Heisenberg
Jawaban: A
9. Diketahui unsur Cu dengan nomor atom 29, maka jumlah elektron maksimum pada orbital d adalah....
- A. 10
- B. 9
- C. 7
- D. 4
- E. 3
Jawaban: A
10. Unsur F, Cl, dan Br pada tabel periodik unsur mempunyai kesamaan pada….
- A. Jumlah proton
- B. Nomor atom
- C. Nomor massa
- D. Jumlah kulit atom
- E. Elektron valensi
Jawaban: E
11. Neon dan kripton berada pada golongan yang sama karena mempunyai kesamaan….
- A. Jumlah kulit atom
- B. Jumlah proton
- C. Jumlah elektron
- D. Konfigurasi elektron
- E. Elektron valensi
Jawaban: E
12. Unsur X terletak pada periode 4 golongan VA. Konfigurasi elektron unsur X adalah….

Jawaban: A
13. Unsur-unsur berikut yang memiliki konfigurasi elektron stabil adalah….
- A. 11Na dan 12Mg
- B. 32S dan 36Kr
- C. 35Br dan 10Ne
- D. 49In dan 18Ar
- E. 54Xe dan 2He
Jawaban: E
14. Diketahui harga keelektronegatifan unsur-unsur P, Q, R, S dan T berturut-turut 2,46; 1,45; 1,74; 2,83; dan 1,00. Urutan letak unsur-unsur tersebut dalam satu periode dari kiri ke kanan adalah....
- A. T, S, R, Q, dan P
- B. T, Q, R, P, dan S
- C. T, S, P, R, dan Q
- D. S, P, R, Q, dan T
- E. P, Q, R, S, dan T
Jawaban: B
15. Unsur X memiliki nomor atom 56. Unsur tersebut dapat mencapai konfigurasi elektron stabil dengan membentuk ion….
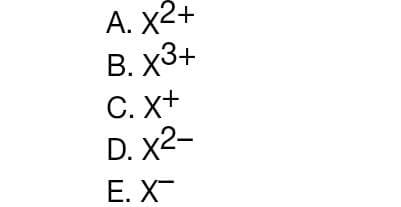
Jawaban: A
16. Arsen dengan nomor atom 33 dan massa 75 termasuk dalam kelompok....
- A. Unsur golongan aluminium
- B. Unsur golongan nitrogen
- C. Unsur golongan halogen
- D. Unsur golongan transisi
- E. Unsur golongan alkali tanah
Jawaban: B
17. Besar kelarutan oksigen dalam air diperkirakan 0,3 persen. Oksigen yang bersifat nonpolar dapat larut dalam air yang bersifat polar karena oksigen dalam air membentuk....
- A. Dipol permanen
- B. Dipol terimbas
- C. Dipol sesaat
- D. Ikatan hidrogen
- E. Gaya London
Jawaban: B
18. Diketahui beberapa senyawa berikut:
- 1) HF
- 2) PCl3
- 3) LiCl
- 4) CaO
- 5) KF
- 6) NH3
Kelompok senyawa yang berikatan kovalen ditunjukkan oleh angka....
- A. 1), 2), dan 6)
- B. 1), 3), dan 5)
- C. 2), 3), dan 5)
- D. 3), 4), dan 5)
- E. 4), 5), dan 6)
Jawaban: A
19. Ikatan logam sangat erat hubungannya dengan salah satu sifat logam berikut kecuali....
- A. Permukaan mengkilat
- C. Titik didih yang tinggi
- D. Titik leleh yang tinggi
- E. Semikonduktor
Jawaban: E
20. Unsur X memiliki nomor massa 39 dan jumlah neutron 20. Jika unsur tersebut berikatan dengan unsur Y yang memiliki harga keempat bilangan kuantum terakhir n = 3, l = 1, m = –1, dan s = –1/2. Rumus senyawa dan jenis ikatan yang terjadi berturut-turut adalah....
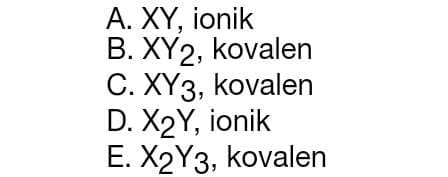
Jawaban : D
21. Komponen yang menyusun inti atom meliputi…
- A. Proton dan elektron
- B. Proton dan neutron
- C. Proton, elektron, dan neutron
- D. Proton saja
- E. Elektron saja
Jawaban: A
22. Saat seorang siswa melakukan praktikum, ia perlu mencium aroma bahan kimia dengan cara yang benar. Cara tersebut adalah....
- A. menutup mata saat menghirup bau bahan kimia
- B. mendekatkan bahan kimia langsung ke hidung dan menghirupnya dalam-dalam
- C. menambahkan air terlebih dahulu sebelum menghirup aromanya
- D. mengibas-ngibaskan tangan di atas bahan kimia ke arah hidung
- E. mengguncang bahan kimia agar aromanya keluar
Jawaban: D
23. Benda dapat mengalami perubahan baik dari segi bentuk maupun susunan partikelnya, sehingga menghasilkan sifat baru yang berbeda dari keadaan awal. Pernyataan ini menggambarkan konsep dalam ilmu kimia yang disebut…
- A. Manfaat
- B. Hakikat
- C. Metode
- D. Hipotesis
- E. Peranan
Jawaban: B
24. Dalam perkembangan ilmu kimia, metode ilmiah selalu diterapkan. Dari langkah-langkah berikut, yang menjadi langkah pertama dalam metode ilmiah adalah…
- A. menyusun hipotesis
- B. melakukan analisis data
- C. menyiapkan peralatan
- D. merumuskan masalah
- E. mengamati fenomena
Jawaban: D
25. Sebuah produk rumah tangga mengandung bahan aktif benzalkonium klorida, yang pada konsentrasi tinggi dapat menyebabkan iritasi kulit atau gangguan mata, termasuk rasa gatal hingga kerusakan kornea. Produk tersebut adalah…
- A. Pembersih rumah tangga
- B. Pengawet makanan
- C. Pemutih pakaian
- D. Pewangi ruangan
- E. Pemanis buatan
Jawaban: A
Soal UAS Kimia Kelas 10 Semester 1 Esai
26. Perhatikan grafik berikut ini !
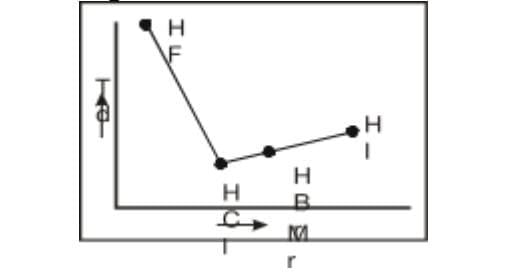
Grafik di atas merupakan grafik titik didih senyawa versus Mr yang dimiliki. Mengapa bisa terjadi demikian? Jelaskan!
Jawaban:
Meningkatnya titik didih HCl, HBr, dan HI disebabkan naiknya Mr molekul sehingga gaya Van der Waals semakin kuat. Senyawa- senyawa yang memiliki Mr besar seharusnya memiliki titik didih yang tinggi. Penyimpangan terjadi pada titik didih HF karena adanya ikatan hidrogen.
Hal ini terjadi karena ikatan hidrogen antara molekul-molekul HF lebih kuat daripada ikatan pada molekul-molekul yang lain. Perbedaan keelektronegatifan dalam molekul HF lebih besar karena unsur F paling elektronegatif dibandingkan unsur Cl, Br, dan I. Energi yang diperlukan untuk memutuskan ikatan dalam molekul HF sangat besar. Oleh karena itu titik didih HF sangat tinggi.
27. Tuliskan 3 perbedaan teori Atom Bohr dan mekanika kuantum!
Jawaban:
Teori Bohr menyebutkan bahwa:
- Elektron mengelilingi inti atom pada lintasan dengan tingkat energi tertentu
- Elektron bergerak dalam lintasannya membentuk lingkaran seperti pergerakan planet mengelilingi matahari
- Posisi sebuah elektron yang bergerak mengelilingi inti atom dapat ditentukan
- Tidak dapat menjelaskan pengaruh medan magnet dalam spektrum atom hidrogen
Teori Mekanika Kuantum menyebutkan bahwa:
- Elektron mengitari inti atom pada orbital tertentu yang membentuk kulit atom
- Elektron bergerak dalam orbital dengan melakukan gerak gelombang
- Posisi sebuah elektron bergerak mengelilingi inti tidak dapat ditentukan dengan pasti
- Mampu menjelaskan pengaruh medan magnet dalam spektrum atom hidrogen dan mampu menjelaskan sifat atom dan molekul
28. Gambarkan struktur Lewis dari senyawa SO3 dan tunjukkan bagian mana yang merupakan ikatan kovalen koordinasi!
Jawaban:

29. Mengapa jumlah sub kulit yang menyusun kulit M hanya terdiri dari 3 subkulit? Jelaskan!
Jawaban:
Kulit M → n = 3. Jika n = 3 maka nilai l = 0 sampai dengan (3 – 1) = 0, 1, 2 Sehingga hanya memiliki 3 subkulit
30. Diketahui atom X (Z = 13) dan Y (Z = 16). Dari soal tersebut temukan:
a. Konfigurasi elektron atom X dan Y!
b. Jika atom X dan Y berikatan, tentukan rumus kimia senyawa yang dibentuk!
c. Sebutkan jenis ikatan yang terbentuk!
Jawaban:
a. Konfigurasi elektron X: 2 8 3 Konfigurasi elektron Y: 2 8 6
b. Rumus senyawa kimia jika atom X dan Y berikatan:
13X (2 8 3) → X3+ (2 8) + 3e– x 2
16Y (2 8 6) + 2e– → Y2– (2 8 8) x 3
2 13X (2 8 3) + 3 16Y(2 8 6) → 2 X3+ (2 8) + 3 Y2– ( 2 8 8)
Rumus senyawa ion = 2 X3+ + 3 Y 2– → X2Y3
c. Ikatan ion
Download Soal PAS Kimia Kelas 10 Semester 1 Kurikulum Merdeka PDF
Selain melalui contoh soal di atas, siswa bisa menemukan contoh latihan soal PAS Kimia kelas 10 semester 1 lainnya lewat tautan unduhan di bawah ini. Di sana akan dijumpai kumpulan soal PAS Kimia kelas 10 semester 1 Kurikulum Merdeka PDF. Silakan unduh dan belajar latihan soal lainnya.
Berikut tautan unduhan kumpulan contoh soal UAS Kimia kelas 10 semester 1 dalam format PDF:
LINK DOWNLOAD SOAL PAS KIMIA KELAS 10 SEMESTER 1 KURIKULUM MERDEKA PDF
Penulis: Ririn Margiyanti
Editor: Iswara N Raditya & Yonada Nancy
Penyelaras: Ibnu Azis