tirto.id - Model Atom Bohr dijelaskan oleh Niels Bohr sejak tahun 1913. Dalam teorinya, fisikawan asal Denmark ini menyatakan konsep elektron yang bergerak mengelilingi inti atom sebagai orbitnya (titik pusat perputarannya).
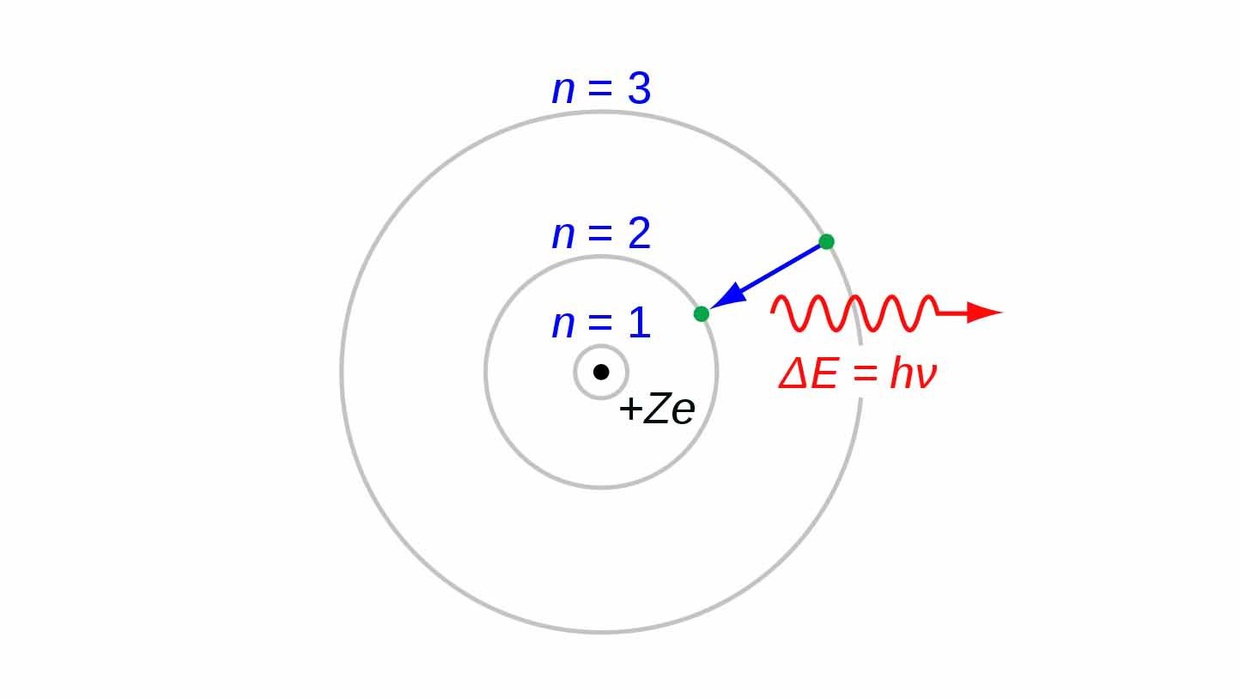
Sebagaimana dilansir laman Batan, teori atom Bohr menegaskan adanya elektron yang mengelilingi atom bermuatan proton dan neutron—terlihat seperti planet-planet yang mengelilingi matahari dalam tata surya.
Akan tetapi, orbit atau garis lintasan elektron dengan inti atom ini memiliki jarak-jarak tertentu sesuai dengan tingkatan energi dari elektronnya. Oleh karena itu, model atom Bohr ini tergambar lebih menyerupai sebuah titik pusat yang dikelilingi oleh lintasan-lintasan dengan jarak tertentu.
Bunyi Model Atom Bohr
Berdasarkan catatan Fadillah Okty Myranthika dalam Modul Kimia Kelas X (2020:9), terdapat sejumlah empat poin kesimpulan yang didapatkan dari sifat atom menurut model atom Bohr. Berikut ini poin-poin sifat tersebut:
- Atom terbentuk dari sebuah inti yang memiliki muatan positif lalu dikelilingi oleh elektron yang menyerupai lintasan (bermuatan negatif).
- Elektron yang mengelilingi atom bisa pindah dari satu lintasan ke jalur lain
- Jika elektron pindah ke lintasan yang lebih tinggi, ia akan melakukan penyerapan energi
- Apabila pindahnya ke lintasan yang lebih rendah, akan memancarkan energi.
Tingkatan Energi Model Atom Bohr
Secara garis besar, elektron yang melintas di orbit terendah mempunyai energi yang kecil. Sedangkan lintasan yang berada lebih tinggi, memiliki energi elektron yang takarannya lebih besar dibanding yang bawahnya.
Posisi elektron yang terdapat di lintasan berdasarkan tingkat energinya ini kadang dikenal juga dengan rangkaian kulit-kulit elektron atom. Mengingat elektron dapat berpindah ke lintasan atau kulit lain, tentu ada juga sebab-akibat yang berlangsung selama prosesnya.
Menurut catatan Muchtaridi dan Sandri Justiana dalam Kimia 1 (2007:30), tingkatan energi pada teori atom Bohr mengisyaratkan beberapa baris lintasan yang diisi oleh elektron sebagai pengeliling atom. Elektron ini dapat berpindah dari sebuah lintasan ke lintasan lain melalui proses eksitasi dan deeksitasi.
Proses eksitasi ini dijabarkan sebagai kasus ketika tingkat energi pindah dari lintasan rendah ke tempat yang lebih tinggi. Biasanya, hal ini terjadi akibat adanya penyerapan energi.
Sedangkan deeksitasi, dijelaskan sebagai perpindahan energi dari tingkat tinggi ke yang lebih rendah dari sebelumnya. Proses ini terjadi akibat adanya sebuah pemancaran energi.
Kendati Bohr sudah menjelaskan kebaruan dalam penelitian atom, tetap terdapat kekurangan dari teori yang diungkapkannya. Pertama, jarak dan orbit yang ditekankan dalam model atom Bohr tidak sejalan dengan “Prinsip Ketidakpastian Heisenberg”, yakni jarak/radius tak bisa bersama dengan orbit.
Kedua, teori atom Bohr juga tidak mampu memberikan jawaban atas Efek Zeeman, yaitu efek yang ketika garis spectrum terbagi-bagi akibat adanya sebuah medan magnet.
Contoh Gambar Atom Bohr
Terlepas dari itu, Bohr melalui model atom Bohr tetap tercatat sebagai salah satu ilmuwan yang mengembangkan teori atom. Untuk melihat gambar contoh model atom tersebut, Anda dapat mengaksesnya melalui link berikut ini:
Penulis: Yuda Prinada
Editor: Yulaika Ramadhani
 Masuk tirto.id
Masuk tirto.id