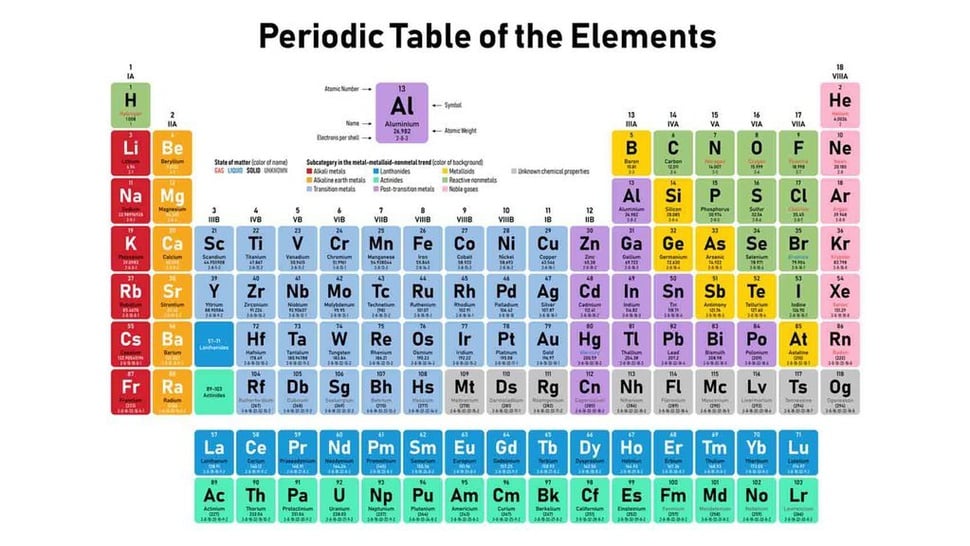
tirto.id - Sifat unsur periode 3 dan senyawanya adalah hal yang akan dibahas ketika mempelajari tabel periodik kimia. Unsur periode ketiga adalah unsur-unsur yang memiliki jumlah kulit utama 3, dan jumlah elektron valensi yang berbeda. Valensi elektron dimulai dari satu hingga delapan.
Unsur-unsur periode ketiga meliputi natrium (Na), magnesium (mg), alumunium (Al), silikon (Si), fosforus atau fosfor (P), belerang (S), klorin(Cl) dan argon (Ar)
Perbedaan elektron valensi menyebabkan perbedaan sifat kimia. Karena sifat kimia yang berbeda dalam satu periode dari kiri ke kanan mempunyai kenaikan yang teratur sehingga sifat kimianya berubah bertahap Sifat Fisik Unsur Periode Ketiga
| Unsur | Na | Mg | Al | Si | P | S | Cl | Ar |
| Titik Leleh (Derajat Celcius) | 98 | 650 | 660 | 1430 | 44 | 199 | -102 | -189 |
| Titik Didih (Derajat Celcius) | 892 | 1100 | 2460 | 2355 | 280 | 445 | -34 | -186 |
| Daya Hantar Listrik | K | K | K | K | I | I | I | I |
K: Konduktor
Sifat Kimia Unsur Periode Ketiga
| Nama Unsur | Lambang Unsur | Nomor Atom | Konfigurasi Elektron |
| Natrium | Na | 11 | 1 s2 2s2 2p6 3s1 |
| Magnesium | Mg | 12 | 1 s2 2s2 2p6 3s2 |
| Alumunium | Al | 13 | 1 s2 2s2 2p6 3s2 p1 |
| Silikon | Si | 14 | 1 s2 2s2 2p6 3s2 p2 |
| Fosfor | P | 15 | 1 s2 2s2 2p6 3s2 p3 |
| Sulfur | S | 16 | 1 s2 2s2 2p6 3s2 p4 |
| Klor | Cl | 17 | 1 s2 2s2 2p6 3s2 p5 |
| Argon | Ar | 18 | 1 s2 2s2 2p6 3s2 p6 |
1. Proses Pembuatan Unsur Periode 3
a) Natrium
Natrium merupakan unsur alkali dengan daya reduksi paling rendah, dengan sumber utamanya adalah halit (umumnya dalam bentuk NaCl). Pembuatan natrium dapat dilakukan dengan proses Downs, yaitu elektrolisis lelehan NaCl.Air asin yang mengandung NaCl diuapkan sampai kering kemudian padatan yang terbentuk dihancurkan untuk kemudian dilelehkan. Sedangkan untuk mengurangi biaya pemanasan, NaCl (titik lebur 801 °C) dicampur dengan 1½ bagian CaCl2 untuk menurunkan suhu lebur hingga 580 °C.
b) Magnesium
Magnesium dapat diperoleh melalui proses Downs:- Magnesium diendapkan sebagai magnesium hidroksida dengan menambahkan Ca(OH)2 ke dalam air laut.
- Tambahkan asam klorida untuk mendapatkan kloridanya, yang kemudian diperoleh kristal magnesium klorida (MgCl.6H2O).
- Elektrolisis leburan kristal magnesium dengan terlebih dahulu menambahkan magnesium klorida yang mengalami hidrolisis sebagian ke campuran leburan natrium dan kalsium klorida. Hal ini dilakukan untuk menghindari terbentuknya MgO saat kristal MgCl.6H2O dipanaskan.
- Magnesium akan terbentuk pada katode. Reaksi:
Mg2+ + Ca(OH)2 (s) → Mg(OH)2 (s) + Ca2+
Mg(OH)2 (s) + 2 H+ + Cl– → MgCl.6H2O
Katode : Mg2+ + 2e– → Mg
Anode : 2 Cl– → Cl2 (g) + 2e-
c) Alumunium
Aluminium diperoleh dari elektrolisis bauksit yang dilarutkan dalam kriolit cair. Proses ini dikenal dengan proses Hall Heroult. Pada proses ini bauksit ditempatkan dalam tangki baja yang dilapisi karbon dan berfungsi sebagai katode. Adapun anode berupa batang-batang karbon yang dicelupkan dalam campuran.d) Silikon
Silikon dapat dibuat dari reduksi SiO2 murni dengan serbuk aluminium pada suhu tinggi, dengan reaksi seperti berikut:4Al(s) + 3SiO2(s) → 2Al2O3(l) + 3Si(s)
e) Fosfor
Phosphor atau fosfor dibuat dalam tanur listrik dengan memanaskan fosforit, pasir, dan kokas dengan reaksi seperti berikut:Ca3(PO4)2(l) + 3SiO2(s) → 3CaSiO3(l) + P2O5 (s)
2P2O5(s) + 10C(s) → P4(s) + 10CO(g)
Dalam proses ini dihasilkan phosphor kuning. Adapun phosphor merah dihasilkan dengan jalan memanaskan phosphor kuning pada suhu 250 °C tanpa udara.
f) Sulfur
Pembuatan belerang pertama kali dikembangkan pada tahun 1904 oleh Frasch yang mengembangkan cara untuk mengekstrak belerang yang dikenal dengan cara Frasch.g) Klor
Klorin dapat dibuat menggunakan beberapa cara, yaitu:- Proses Deacon (oksidasi) HCl dicampur dengan udara, kemudian dialirkan melalui CuCl2 yang bertindak sebagai katalis.
- Reaksi terjadi pada suhu ± 430 °C dan tekanan 20 atm.
- Elektrolisis larutan NaCl menggunakan diafragma.
- Elektrolisis lelehan NaCl
h) Argon
Argon dapat diperoleh dari atmosfer/udara bebas secara destilasi fraksional pada udara cair atau dengan mengemisikan positron / electron ke atom K.K + 1e → Ar(40) isotop Ar dengan proton 40
2. Kelimpahan Unsur Periode 3
- Natrium, dengan massa 2,7%, dan kandungan mineral: sendawa chili (NaNO3), kriolit (Na3AlF6), bijih silikat (Na2SiO3).
- Magnesium, dengan massa 1,9%, dan kandungan mineral: dolomit (MgCO3.CaCO3), magnesit (MgCO3), asbestor (CaMg3(SiO3)4), garam inggris (MgSO4.7H2O)
- Aluminium, dengan massa 7,6%, dan kandungan mineral: Kryolit (Na3AlF6), Bauksit (Al2O3.nH2O), Kaolin/Tanah Liat (Al2O3.6SiO2.2H2O), Tawas K2SO4Al2(SO4)3.24H2O
- Silikon, dengan massa 25,8%, dan kandungan mineral: Silika (pasir, kuarsa), silikat (liat, mika)
- Phosphor, dengan massa 0,1%, dan kandungan mineral: Fosforit Ca3(PO4)2, Apatit 3Ca3(PO4)2.CaF2
- Sulfur, dengan massa < 0,1%, dan kandungan mineral: FeS2 (pirit), ZnS (sfaterit), PbS (galenit), CaSO4 (gips), BaSO4 (barit)
- Klor, dengan massa 0,2%, dan kandungan mineral: Senyawa halite (NaCl), silvite (KCl), MgCl2 dan CaCl2
- Argon, dengan massa < 0,1%, dan tidak memiliki kandungan mineral.
3. Manfaat Unsur Periode 3
a) Natrium
Kegunaan unsur periode ini dipakai dalam pembuatan ester- NACl digunakan oleh hampir semua makhluk
- Na-benzoat dipakai dalam pengawetan makanan
- Na-glutamat dipakai untuk penyedap makanan
- Isi dari lampu kabut dalam kendaraan bermotor
- NAOH dipakai untuk membuat sabun, deterjen, kertas
- NAHCO3 dipakai sebagai pengembang kue
- Memurnikan logam K, Rb, Cs
- NACO3 Pembuatan kaca dan pemurnian air sadah
b) Magnesium
Dipakai pada proses produksi logam, kaca, dan semen- Untuk membuat konstruksi pesawat. Logamnya disebut magnalium
- Pemisah sulfur dari besi dan baja
- Dipakai pada lempeng yang digunakan di industri percetakan
- Untuk membuat lampu kilat
- Sebagai katalis reaksi organik
c) Alumunium
- Banyak dipakai dalam industri pesawat
- Untuk membuat konstruksi bangunan
- Dipakai pada berbagai macam aloi
- Untuk membuat magnet yang kuat
- Tawas sebagai penjernih air
- Untuk membuat logam hybrid yang dipakai pada pesawat luar angkasa
- Membuat berbagai alat masak
- Menghasilkan permata berwarna-warni: Sapphire, Topaz, dll
d) Silikon
- Dipakai dalam pembuatan kaca
- Terutama dipakai dalam pembuatan semi konduktor
- Digunakan untuk membuat aloi bersama alumunium, magnesium, dan tembaga
- Untuk membuat enamel
- Untuk membuat IC
e) Fosfor
- Dipakai pada proses produksi logam, kaca, dan semen
- Untuk membuat konstruksi pesawat.
- Pemisah sulfur dari besi dan baja
- Dipakai pada lempeng yang digunakan di industri percetakan
- Untuk membuat lampu kilat
- Sebagai katalis reaksi organik
f) Sulfur
- Dipakai sebagai bahan dasar pembuatan asam sulfat
- Digunakan dalam baterai
- Dipakai pada fungisida dan pembuatan pupuk
- Digunakan pada korek dan kembang api
- Digunakan sebagai pelarut dalam berbagai proses
g) Klor
- Dipakai pada proses pemurnian air
- Cl2 dipakai pada disinfektan
- KCl digunakan sebagai pupuk
- ZnCl2 digunakan sebagai solder
- NH4Cl digunakan sebagai pengisi baterai
- Digunakan untuk menghilangkan tinta dalam proses daur ulang kertas
- Dipakai untuk membunuh bakteri pada air minum
- Dipakai pada berbagai macam industri
h) Argon
- Sebagai pengisi bola lampu karena Argon tidak bereaksi dengan kawat lampu
- Dipakai dalam industri logam sebagai inert saat pemotongan dan proses lainnya
- Untuk membuat lapisan pelindung pada berbagai macam proses
- Untuk mendeteksi sumber air tanah
- Dipakai dalam roda mobil mewah.
Sifat Asam Basa Unsur Periode Tiga
Unsur periode 3 memiliki sejumlah sifat asam basa. Jika unsur periode 3 semakin ke kanan, harga energi yang dimiliki cenderung bertambah. Artinya, unsur tersebut menjadi lebih kuat untuk menarik elektron.
Selain itu, semakin kuat sebuah unsur menarik elektron, sifat basanya menjadi makin berkurang. Lalu, sifat asamnya akan semakin bertambah.
Sifat Reduktor dan Oksidator Unsur Periode Tiga
Unsur periode 3 juga memiliki sifat reduktor dan oksidator. Kedua sifat tersebut ditentukan melalui besarnya nilai potensial reduksi standar (E°) pada setiap unsur dalam periode 3.
Jika potensial reduksi standar menuju ke arah kanan, maka semakin positif. Akibatnya yaitu unsur ini semakin ke kanan menjadi lebih mudah mengalami reaksi reduksi. Dengan demikian, sifat oksidatornya makin bertambah dan sifat reduktor lebih berkurang.
Penulis: Ahmad Efendi
Editor: Yulaika Ramadhani
Penyelaras: Yulaika Ramadhani & Ilham Choirul Anwar