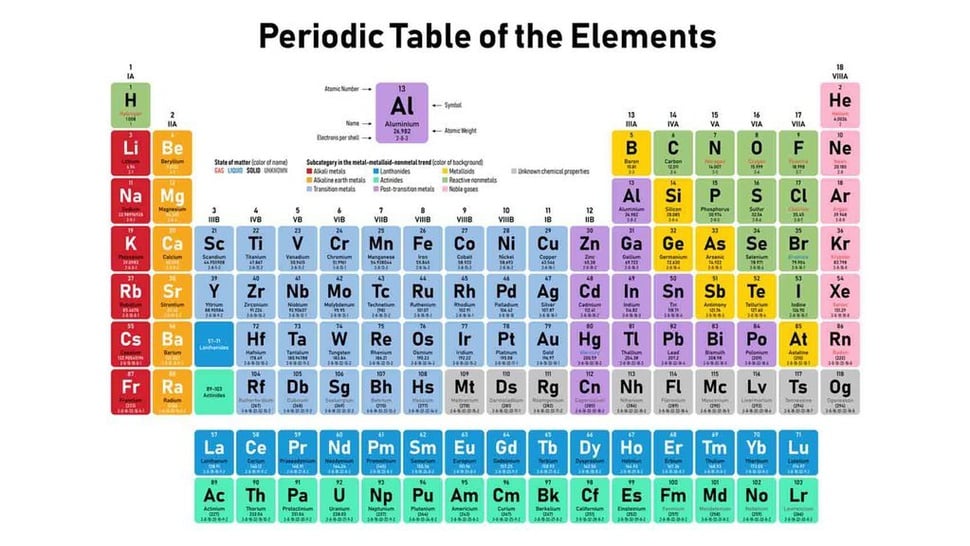
tirto.id - Tabel periodik unsur PDF diperlukan oleh peserta didik maupun mahasiswa yang sedang mempelajari studi kimia. Adapun tabel periodik unsur kimia adalah tabel yang menampilkan unsur-unsur kimia dalam kehidupan.
Unsur-unsur tersebut disusun berdasarkan nomor atom, yaitu jumlah proton dalam inti atom, konfigurasi elektron, dan keberulangan sifat kimia.
Kemudian tabel periodik terbagi menjadi 4 blok, yaitu blok s, p, d, dan f. Tabel tersebut juga memisahkan periode atau baris untuk menentukan unsur, yakni di bagian kiri bersifat logam dan kanan non-logam.
Link Download Tabel Periodik Unsur Kimia PDF
Berikut ini daftar link download tabel periodik unsur kimia.
Keterangan Tabel Periodik
Tabel periodik unsur kimia dan keterangannya dapat dipantau melalui poin-poin berikut.
- Baris pada tabel disebut dengan periode, lalu kolom disebut dengan golongan.
- Ada 6 golongan (kolom) mempunyai nama selain nomor. Contohnya adalah unsur golongan 17 ialah halogen, dan golongan 18 adalah gas mulia.
- Tabel periodik dapat digunakan untuk menurunkan hubungan antara sifat-sifat unsur, dan memperkirakan sifat unsur baru yang belum ditemukan.
- Tabel periodik memberikan kerangka kerja untuk melakukan analisis perilaku kimia, banyak digunakan dalam bidang kimia.
Konfigurasi Elektron dan Unsur Tabel Periodik
Nomor kulit dan jumlah elektron yang ada pada subkulit menunjukkan letak unsur pada tabel periodik.
Dalam tabel periodik bentuk panjang letak unsur-unsur dibagi dalam beberapa blok sesuai dengan letak elektron pada kulit terluarnya yaitu blok s, p, d, dan f.
Ada hubungan antara konfigurasi elektron dengan letak unsur pada tabel periodik.
Hubungan konfigurasi elektron dengan letak unsur pada tabel periodik untuk golongan utama (blok s dan p) dan golongan transisi (blok d dan f) berbeda.
Letak unsur pada tabel periodik dapat ditentukan dengan mengetahui nomor golongan dan nomor periode. Sedangkan, nomor golongan dan nomor periode dapat ditentukan dari konfigurasi elektron.
Kemudian, nomor golongan ditentukan dari jumlah elektron pada kulit terluar, sedangkan nomor periode ditentukan dari nomor kulit terbesar.
Cara Baca Tabel Periodik Unsur Kimia
Berikut ini sejumlah elemen yang perlu Anda pahami, sebagai cara baca tabel periodik unsur kimia.
1. Baca tabel periodik dari kiri atas ke kanan bawah
Unsur-unsur tersusun berdasarkan nomor atomnya. Semakin ke kanan dan ke bawah, nomor atomnya semakin besar.
Nomor atom adalah banyaknya proton yang dimiliki atom unsur. Semakin ke kanan, Anda juga akan melihat bahwa nomor massa setiap atom bertambah besar.
Artinya, Anda dapat memahami berat unsur walaupun hanya dengan melihat letaknya pada tabel.
Semakin ke kanan atau ke bawah, massa atom unsur akan bertambah karena massa atom dihitung dengan menjumlahkan proton dan neutron di setiap atom unsur. Jumlah proton bertambah bersama unsurnya, yang berarti beratnya juga naik.
Elektron tidak termasuk dalam massa atom karena dibandingkan proton dan neutron, elektron tidak berpengaruh banyak terhadap berat atom.
2. Pahami unsur Kimia
Pahami bahwa setiap unsur mengandung 1 proton lebih banyak daripada atom di sebelah kirinya.
Anda dapat mengetahui ini dengan melihat nomor atom. Nomor atom tersusun dari kiri ke kanan. Unsur-unsur juga dipisahkan menjadi 3 kelompok, Anda dapat melihat pengelompokannya pada tabel.
Contohnya, baris pertama mencantumkan hidrogen, yang memiliki nomor atom 1, dan helium, yang memiliki nomor atom 2.
Namun, kedua unsur ini terletak pada ujung tabel kiri dan kanan karena berada pada kelompok yang berbeda.
3. Kenali golongan atom, yang memiliki sifat fisik dan kimia yang sama
Golongan ditunjukkan oleh kolom vertikal. Dalam banyak kasus, golongan dicirikan dengan warna yang sama.
Hal ini membantumu mengidentifikasi unsur mana yang memiliki sifat fisik dan kimia yang mirip.
Dengan demikian, Anda akan lebih mudah memperkirakan reaksi unsur-unsur tersebut. Setiap unsur pada golongan tertentu memiliki jumlah elektron yang sama pada orbital terluarnya.
Sebagian besar unsur hanya masuk ke satu golongan. Namun, hidrogen bisa dikelompokkan dalam golongan halogen atau logam alkali. Pada beberapa tabel, hidrogen muncul di kedua golongan tersebut.
Dalam banyak kasus, kolom akan diberi nomor 1-18, baik di atas maupun di bawah tabel. Angka-angka tersebut dapat ditampilkan dalam angka romawi (IA), angka arab (1A), atau angka (1).
Bacalah golongan atom mengikuti kolomnya dari atas ke bawah.
4. Perhatikan ruang kosong pada tabel
Selain berdasarkan nomor atom, penyusunan unsur-unsur ke dalam kelompok dan golongan juga mempertimbangkan sifat fisik dan kimia yang sama. Dengan cara ini, Anda akan lebih mudah memahami cara setiap unsur bereaksi.
Bertambahnya unsur kimia membuat penggolongannya semakin sulit sehingga tidak heran jika tabel periodik memuat ruang kosong.
Contohnya, 3 baris pertama memiliki ruang kosong, karena logam transisi yang dimunculkan di tabel adalah unsur yang memiliki nomor atom 21.
Demikian pula, unsur 57 hingga 71, yang merupakan unsur bumi langka atau unsur tanah jarang, digambarkan terpisah pada kanan bawah tabel.
5. Perhatikan bahwa setiap baris disebut periode
Semua unsur dalam satu periode memiliki jumlah orbital atom yang sama, yang nantinya akan dilintasi elektron.
Jumlah orbital akan sesuai dengan jumlah periode. Tabel periodik memperlihatkan 7 baris, yang berarti terdapat 7 periode.
Sebagai contoh, unsur pada periode 1 memiliki 1 orbital, sementara unsur pada periode 7 memiliki 7 orbital.
Dalam banyak kasus, periode diberi nomor 1-7 dari atas ke bawah pada sisi kiri tabel.
Bacalah periode unsur mengikuti barisnya dari kiri ke kanan.
6. Bedakan antara logam, semilogam, dan nonlogam
Anda dapat lebih memahami sifat-sifat unsur dengan mengenali jenis unsur tersebut.
Untungnya, sebagian besar tabel periodik menggunakan warna untuk menunjukkan apakah unsur tersebut masuk kelompok logam, semilogam, atau nonlogam.
Anda akan menemukan unsur logam di kanan tabel, sementara nonlogam di sisi kiri. Adapun kelompok semilogam terletak di antara logam dan nonlogam.
Ingatlah bahwa hidrogen dapat dikelompokkan dengan halogen atau logam alkali karena sifatnya. Oleh karena itu, wajar jika hidrogen dapat muncul di kedua sisi tabel atau berbeda warna.
Unsur disebut logam apabila mengilap, berwujud padat pada suhu ruang, menghantar panas dan listrik, serta lunak dan elastis.
Unsur dianggap nonlogam apabila tidak mengilap, tidak menghantar panas atau listrik, dan keras. Unsur-unsur ini biasanya berwujud gas pada suhu ruang, namun bisa juga menjadi padat atau cair pada suhu tertentu.
Unsur disebut semilogam apabila memiliki gabungan sifat dari logam dan nonlogam.
Nama Unsur Kimia, Simbol/Singkatan, dan Nomor Atom
Beirkut ini daftar nama unsur kimia, simbol dan singkatan, serta nomor atom yang terdapat di tabel unsur periodik.
- Actinium (Ac) 89
- Alumunium (Al) 13
- Americium (Am) 95
- Antimony (Sb) 51
- Argon (Ar) 18
- Arsenic (As) 33
- Astatine (At) 85
- Barium (Ba) 56
- Berkelium (Bk) 97
- Beryllium (Be) 4
- Bismuth (Bi) 83
- Bohrium (Bh) 107
- Boron (B) 5
- Bromine (Br) 35
- Cadmium (Cd) 48
- Calcium/Kalsium (Ca) 20
- Californium (Cf) 98
- Carbon (Karbon) C 6
- Cerium (Ce) 58
- Cesium (Cs) 55
- Chlorine (Cl) 17
- Chromium (Cr) 24
- Cobalt (Co) 27
- Copper/Cupprum (Tembaga) Cu 29
- Curium (Cm) 96
- Darmstadtium (Ds) 110
- Dubnium (Db) 105
- Dysprosium (Dy) 66
- Einsteinium (Es) 99
- Erbium (Er) 68
- Europium (Eu) 63
- Fermium (Fm) 100
- Fluorine (F) 9
- Francium (Fr) 87
- Gadolinium (Gd) 64
- Gallium (Ga) 31
- Germanium (Ge) 32
- Gold/Aurum (Emas) Au 79
- Hafnium (Hf) 72
- Hassium (Hs) 108
- Helium (He) 2
- Holmium (Ho) 67
- Hidrogen (H) 1
- Indium (In) 49
- Iodine (Yodium) I 53
- Iridium (Ir) 77
- Iron/Ferrum (Besi) Fe 26
- Krypton (Kr) 36
- Lanthanum (La) 57
- Lawrencium (Lr) 103
- Lead/Plumbum (Timbal) Pb 82
- Lithium (Li) 3
- Lutetium (Lu) 71
- Magnesium (Mg) 12
- Manganese (Mn) 25
- Meitnerium (Mt) 109
- Mendelevium (Md) 101
- Mercury/Hydrargyrum/Raksa (Hg) 80
- Molybdenum (Mo) 42
- Neodymium (Nd) 60
- Neon (Ne) 10
- Neptunium (Np) 93
- Nickel (Ni) 28
- Niobium (Nb) 41
- Nitrogen (N) 7
- Nobelium (No) 102
- Osmium (Os) 76
- Oksigen (O) 8
- Palladium (Pd) 46
- Phosphorus/Fosfor (P) 15
- Platinum (Pt) 78
- Plutonium (Pu) 94
- Polonium (Po) 84
- Potasium/Kalium (K) 19
- Praseodymium (Pr) 59
- Promethium (Pm) 61
- Protactinium (Pa) 91
- Radium (Ra) 88
- Radon (Rn) 86
- Rhenium (Re) 75
- Rhodium (Rh) 45
- Roentgenium (Rg) 111
- Rubidium (Rb) 37
- Ruthenium (Ru) 44
- Rutherfordium (Rf) 104
- Samarium (Sm) 62
- Scandium (Sc) 21
- Seaborgium (Sg) 106
- Selenium (Se) 34
- Silikon (Si) 14
- Silver/Argentum/Perak (Ag) 47
- Sodium/Natrium (Na) 11
- Strontium (Sr) 38
- Sulfur/Belerang (S) 16
- Tantalum (Ta) 73
- Technetium (Tc) 43
- Tellurium (Te) 52
- Terbium (Tb) 65
- Thallium (Tl) 81
- Thorium (Th) 90
- Thulium (Tm) 69
- Tin/Stannum (Timah) Sn 50
- Titanium (Ti) 22
- Tungsten (Wolfram) W 74
- Ununbium (Uub) 112
- Ununhexium (Uuh) 116
- Ununoctium (Uuo) 118
- Ununpentium (Uup) 115
- Ununquadium (Uuq) 114
- Ununseptium (Uus) 117
- Ununtrium (Uut) 113
- Roentgenium (Rg) 111
- Uranium (U) 92
- Vanadium (V) 23
- Xenon (Xe) 54
- Ytterbium (Yb) 70
- Yttrium (Y) 39
- Zinc/Seng (Zn) 30
- Zirconium (Zr) 40
Editor: Yulaika Ramadhani
Penyelaras: Yuda Prinada