tirto.id - Vaksinasi Covid-19 akan segera dilakukan di Indonesia dan direncanakan berlangsung mulai 13 Januari 2021. Namun, Presiden Joko Widodo menegaskan vaksinasi tetap harus menunggu ada izin penggunaan darurat dari BPOM.
"Pertanyaannya, vaksinasinya kapan? Kalau tanya seperti itu saya jawab, minggu depan. Harinya apa? Menunggu izin penggunaan darurat dari BPOM, tahapan itu harus kita lalui," kata Jokowi di Istana Kepresidenan Bogor, Jumat (8/1/2021), dikutip dari Antara.
Rencananya, vaksinasi tahap awal akan memanfaatkan vaksin buatan Sinovac. Ia salah satu jenis vaksin pesanan pemerintah RI, selain juga buatan AstraZeneca, Pfizer, Moderna, dan Sinopharm. Hingga 9 Januari 2021, sebanyak 3 juta dosis vaksin buatan Sinovac yang dikirim dari Tiongkok, sudah tiba di Indonesia dan didistribusikan ke daerah secara bertahap. Majelis Ulama Indonesia (MUI) juga sudah menyatakan vaksin Sinovac suci dan halal.
Sementara BPOM masih mengkaji hasil uji klinis fase III vaksin Sinovac, sebelum menerbitkan izin penggunaan darurat atau Emergency Use Authorization (UEA). Selain di Indonesia, proses uji klinis vaksin Sinovac juga di Brasil dan Turki, yang hasilnya juga akan dikaji BPOM.
Hasil Uji Klinis Vaksin Sinovac di Brasil
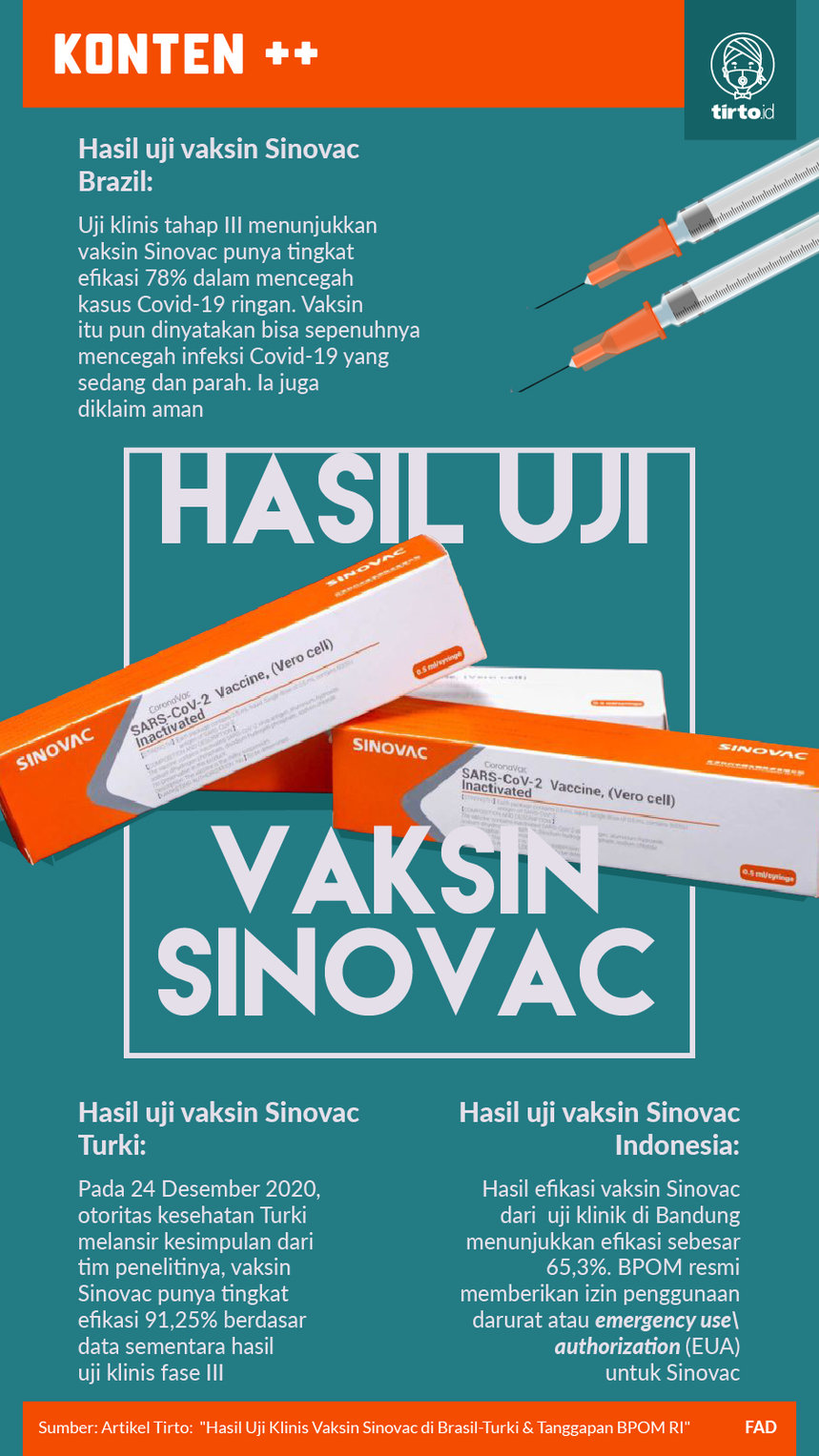
Tim peneliti dari Brasil menyatakan hasil uji klinis tahap III menunjukkan vaksin Sinovac punya tingkat efikasi 78 persen dalam mencegah kasus Covid-19 ringan. Vaksin itu pun dinyatakan bisa sepenuhnya mencegah infeksi Covid-19 yang sedang dan parah. Ia juga diklaim aman.
"Hasil yang kami tahu saat ini luar biasa," kata Rosana Richtmann, dokter dari lembaga penguji vaksin Sinovac di Brazil, Institut Penyakit Menular Emilio Ribas, dalam konferensi pers, Kamis (7/1/2021), demikian dilansir Sciencemag.org.
Efikasi adalah persentase penurunan kasus penyakit di kelompok penerima vaksin, dalam konteks penelitian. Tingkat efikasi 78 persen, berarti tingkat kasus Covid-19 menurun hingga 78 persen di uji klinis fase III, dibandingkan pengujian kepada relawan penerima plasebo. Adapun plasebo merupakan perawatan yang seolah-olah memakai obat atau vaksin, tetapi sesungguhnya ia tidak mengggunakan bahan aktif yang terbukti bisa menyembuhkan atau mencegah penyakit.
Kesimpulan tim peneliti dari Brasil mengenai tingkat kemanjuran vaksin Sinovac ini diperoleh dari pengujian yang melibatkan 12 ribu tenaga kesehatan. Hasil pengujian itu menemukan hanya ada 218 kasus Covid-19 di kalangan partisipan, 160 di antaranya penerima placebo.
Dimas Tadeu Covas, kepala Institut Butantan, lembaga negara yang merupakan mitra Sinovac dalam uji klinis di Brasil, berharap EUA untuk vaksin itu dapat segera terbit. "Kami sekarang memiliki semua dokumen guna mengajukan permintaan [izin] tersebut," kata dia.
Hasil uji klinis tahap akhir tersebut menjadi landasan bagi pemerintah negara bagian Sao Paolo untuk mengajukan permohonan izin penggunaan darurat vaksin Sinovac, dikutip dari APNews.
Gubernur Sao Paolo, Joao Doria mengaku sudah merencanakan vaksinasi untuk 46 juta warga di wilayahnya mulai 25 Januari 2021. "Hari ini adalah hari harapan, hari kehidupan," ujar dia ketika konferensi pers pengumuman hasil uji klinis itu.
Namun, masih mengutip laporan APNews, Institut Butantan Sao Paulo belum mengungkapkan data lebih detail terkait hasil uji klinis 3 itu, seperti jenis kelamin dan usia relawan penerima suntikan, hingga apakah mereka memiliki gejala. Butantan berjanji akan mempublikasikan data itu setelah otoritas kesehatan Brasil menerbitkan penggunaan CoronaVac (nama vaksin Sinovac).
Gubernur Sao Paulo sebenarnya "musuh" Jair Bolsonaro, Presiden Brasil yang telah meremehkan risiko pandemi sejak awal dan sempat mempertanyakan kualitas vaksin asal China. Namun, usai konferensi pers Doria, Menteri Kesehatan Brasil, Eduardo Pazuello, mengatakan pemerintahnya bakal membeli 100 juta dosis vaksin Sinovac. "[Vaksin] Itu akan didistribusikan secara merata dan proporsional ke semua negara bagian, seperti [vaksin] AstraZeneca," kata Pazuello.
Hasil Uji Klinis Vaksin Sinovac di Turki
Pada 24 Desember 2020, otoritas kesehatan Turki melansir kesimpulan dari tim penelitinya, bahwa vaksin Sinovac punya tingkat efikasi 91,25 persen, berdasar data sementara hasil uji klinis fase III. Uji klinis vaksin Sinovac di Turki dimulai pada 14 September 2020 dengan melibatkan 7000 orang. Adapun kesimpulan soal efikasi yang diumumkan itu didasarkan dari data 1.322 orang.
Para peneliti yang berbicara bersama Menteri Kesehatan Turki Fahrettin Koca, mengatakan 26 dari 29 orang yang terinfeksi di masa uji coba merupakan penerima plasebo. Maka itu, penelitian masih terus dilanjutkan. Tim peneliti Turki mengklaim tak menemukan efek samping serius akibat vaksin itu. Efek samping yang umum hanya demam, nyeri ringan, dan sedikit kelelahan.
Menkes Fahrettin Koca berencana menggunakan data hasil uji klinis itu sebagai dasar melisensikan vaksin Sinovac. "Kami sekarang yakin, vaksin itu efektif dan aman bagi masyarakat Turki," kata Koca, seperti dilansir Reuters, 25 Desember 2020.
Lantas, sebanyak 3 juta dosis vaksin Sinovac dikirim ke Turki pada akhir Desember 2020. Menteri Koca menyatakan vaksin itu akan digunakan usai melewati tes selama 14 hari. Sampai 6 Januari 2021, mengutip Anadolu Agency, vaksin Sinovac itu masih diuji di laboratorium guna memeriksa kualitas, efektivitas, dan keandalannya selama masa simpan.
Kementerian Kesehatan Turki menyatakan pengujian di laboratorium adalah proses kontrol kualitas rutin, seperti diterapkan di seluruh dunia, sebelum izin penggunaan darurat diberikan. Jika vaksin itu lolos tes setidaknya 14 hari dan izin penggunaan darurat diterbitkan oleh Lembaga Farmasi dan Alat Kesehatan Turki, vaksinasi akan dimulai untuk petugas kesehatan dan lansia.
Tanggapan BPOM dan Rencana Penerbitan EUA
Kepala Badan Pengawas Obat dan Makanan (BPOM) RI, Penny Lukito memastikan, EUA atau izin penggunaan darurat untuk vaksin Sinovac akan diterbitkan oleh lembaganya sebelum vaksinasi dijalankan di Indonesia. Namun, Penny menegaskan penerbitan EUA tetap harus didasari prinsip kehati-hatian, integritas, independesi, dan transparansi.
"Vaksin yang diberi EUA harus didukung [data] bukti keamanan, khasiat dan mutu yang memadai. Setelah pemberian EUA juga akan terus dipantau khasiat dan keamanan jangka panjangnya," kata Penny dalam konferensi pers yang disiarkan online oleh BPOM pada Jumat (8/1/2021).
"Syarat pemberian EUA adalah vaksin sudah memiliki data [hasil] uji klinis fase 1 dan uji klinis fase 2 lengkap dan data analisis interim uji klinis 3 yang menunjukkan khasiat dan keamanannya."
Penny menambahkan, pada 8 Januari 2021, BPOM menerima data interim hasil uji klinis 3 vaksin Sinovac yang dilakukan di Bandung. Selain menganalisis data pengujian dari Bandung, kata Penny, BPOM akan mengkaji laporan hasil uji klinis fase 3 di Turki dan Brasil.
"Dukungan data saintifik dan [hasil uji] klinis yang masuk [bisa] memberi keyakinan bahwa EUA diberikan setelah vaksin memenuhi syarat keamanan, khasiat, dan mutu," ujar Penny.
Dia mengaku BPOM sudah menjalin komunikasi untuk keperluan berbagi data hasil uji klinis vaksin Sinovac dengan Turki dan Brasil. Sebab, data hasil uji klinis dari dua negara itu juga akan dianalisis oleh BPOM untuk menjadi dasar penerbitan EUA di Indonesia.
"Kami sudah bekomunikasi untuk menggunakannya dalam memberikan EUA, tapi setelah uji klinik di bandung juga sudah selesai," ujar Penny. "Untuk [data dari] Turki sudah lengkap, tetapi [data] dari Brasil masih kami tunggu," ia menambahkan.
Khusus untuk penerbitan EUA pemberian vaksin Sinovac bagi lansia, atau kalangan usia di atas 59 tahun, BPOM akan memakai data hasil uji klinis dari China dan Brasil. Untuk data uji klinis 1 dan 2, BPOM memakai data dari China. Sementara data uji klinis fase 3 dari Brasil.
"Data itu akan kami gunakan untuk [dasar penerbitan] emergency use authorization khusus untuk lansia pada waktunya nanti," jelas Penny.
Editor: Agung DH