tirto.id - Pandemi COVID-19 mengubah hidup orang banyak sekaligus mengancam nyawa mereka. Orang-orang yang tertular mau tak mau harus dikarantina dan bahkan berisiko mengalami gangguan mental. Petugas kesehatan yang melakukan perawatan lebih parah lagi. Selain bahaya tertular, mereka tak bisa bertemu keluarga karena takut menjadi carrier atau pembawa virus. Di tengah kerunyaman itu, munculnya obat COVID-19 tentu sangat mereka nantikan.
Di antara para relawan COVID-19, ada juga yang sudah siap sedia membantu distribusi vaksin tersebut.
“Sekarang saya buka layanan vaksin. Nanti kalau sudah ada, saya distribusiin,” kata relawan COVID-19 yang bertugas di Wisma Atlet pada Maret-April 2020, Ian Pranadi, kepada Tirto, Minggu (13/9/2020).
Sayang, ketulusan para relawan seperti Ian Pranadi harus membentur tembok. Berkali-kali klaim para pejabat dan institusi negara soal penemuan obat atau vaksin COVID-19 hanya menjadi pemanis bibir.
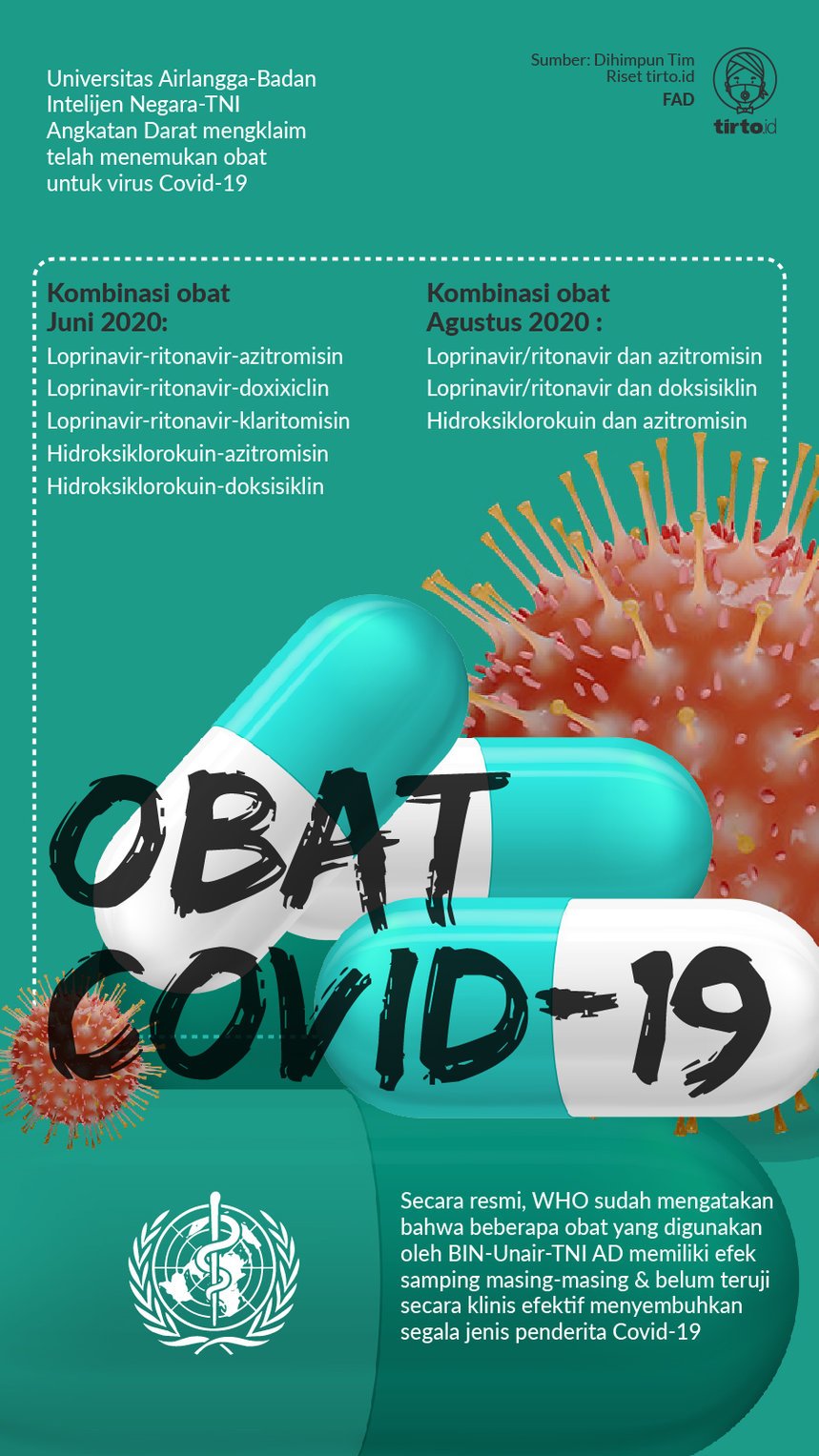
Salah satu penemuan paling ramai adalah obat COVID-19 hasil kolaborasi TNI Angkatan Darat, Universitas Airlangga, dan Badan Intelijen Negara (BIN). Ditemukannya obat ini seakan-akan sudah sangat menjanjikan. Kepala Staf TNI AD Jenderal Andika Perkasa mengatakan tahapan produksi obat tinggal sebentar lagi.
"Berdasarkan penjelasan dari ketua tim pelaksana research tadi, semua sudah memenuhi dengan science yang sudah didukung," kata Andika dalam konferensi pers di Mabes TNI AD, Sabtu (15/8/2020).
Andika menyebut bahwa obat garapan dua lembaga negara dan satu perguruan tinggi negeri ini sudah menyembuhkan 754 pasien COVID-19 tanpa ventilator atau alat bantu pernapasan.
Mereka adalah hasil seleksi dari 1.127 subjek yang rencananya akan menjadi target obat tersebut. Jumlah ini sudah melebihi standar BPOM sebanyak 696 pasien. Sebagian besar dari mereka adalah klaster Sekolah Calon Perwira (Secapa) TNI AD Bandung, Jawa Barat.
Rektor Unair Mohammad Nasih punya keyakinan yang sama dengan Andika: obat yang mereka usahakan akan menjadi obat pertama COVID-19 di dunia. Di depan ratusan orang, Nasih mengaku penelitian ini sudah dilakukan selama setengah tahun sebelum diumumkan di depan publik.
Kendati uji klinik belum sepenuhnya sukses, Nasih optimis karena obat yang mereka temukan ini hanya merupakan campuran dari beberapa obat yang sudah ada, yakni loprinavir-ritonavir-azitromisin, loprinavir-ritonavir-doksisiklin, loprinavir-ritonavir-klaritomisin, hidroksiklorokuin-azitromisin, dan hidroksiklorokuin-doksisiklin. Dia penelitian, sekali lagi, meski tanpa dasar yang jelas, obat ini tak punya efek samping berbahaya.
Beberapa waktu kemudian, Badan Pengawas Obat dan Makanan (BPOM) mengumumkan bahwa mereka tidak mengakui kevalidan uji klinis dari Unair. Namun Nasih masih percaya diri bahwa penelitian mereka mampu mengobati COVID-19.
“Kami sudah sangat senang, kombinasi obat kami juga sudah direkomendasikan [oleh beberapa perhimpunan dokter] untuk obati COVID-19 ringan,” kata Nasih kepada Tirto, Selasa (16/9/2020).
Nasih kemudian berharap pihak berwenang segera merespons cepat penemuan ini. Baginya, masalah transparansi tidak begitu penting dan tak perlu diumbar ke publik. Nasih juga tidak merasa ada urgensi data-data penelitian bisa diakses karena menurutnya vaksin yang sedang dikembangkan pun tidak punya penyajian data yang lengkap.
“Bagi sebagian besar masyarakat, tidak butuh data itu. Bagi mereka, yang penting segera ada obat. Hanya kalangan tertentu saja yang entah untuk apa, perlu data itu. Penyajian data lebih sebagai pertanggungjawaban kami ke masyarakat bahwa kami sudah melakukan sesuatu untuk ikut mengatasi pandemi,” tegasnya.
Terkait gembar-gembor sebelum obat berhasil melewati tahapan uji klinik yang valid terlalu prematur atau tidak, Nasih menolak berkomentar. Menurut dia karena proses tahapan obat ini masih ditangani BPOM, ia "belum bisa kasih komentar" dan “pelanggaran katanya kalau sampai kasih komentar.”
Jalan Panjang Vaksin dan Obat COVID-19
Dari lima kombinasi yang disebutkan Nasih, hanya tiga yang didaftarkan untuk uji klinik. Pertama loprinavir-ritonavir-azitromisin, kemudian loprinavir-ritonavir-doksisiklin, dan terakhir hidroksiklorokuin-azitromisin.
Masalah awal, kelima jenis obat itu, sebagian besar, belum terbukti keefektifannya. Komite Pelaksana Uji klinik Internasional yang dibentuk WHO untuk menakar keefektifan perawatan pasien COVID-19 merekomendasikan WHO agar menghentikan penggunaan hidroksiklorokuin dan lopinavir/ritonavir karena hasil yang tak konsisten.
Salah satu uji coba pemberian obat ini kepada 100 ribu pasien justru menghasilkan angka kematian yang lebih tinggi dan detak jantung pasien menjadi tidak teratur. Sedangkan azitromisin dan doksisiklin membutuhkan penelitian lebih panjang karena tidak ada penelitian efek samping maupun efektivitas kedua obat tersebut dalam perawatan pasien COVID-19.
Untuk azitromisin sendiri, Jennifer Lighter dan Vanessa Raabe dari pusat kesehatan Langone Health, Universitas New York, penelitian bahwa pasien yang diberi hidroksiklorokuin punya persentase bertahan hidup lebih baik daripada mereka yang diberi kombinasi bersama azitromisin.
Pasien yang diberi obat adalah mereka yang tidak menggunakan ventilator atau biasanya masuk dalam kategori OTG. Pasien gejala berat seharusnya menggunakan ventilator karena mendapat masalah pernapasan. Namun dalam paparan TNI AD di situsnya, pasien yang masuk kategori sedang dan berat juga diuji coba. Hanya saja dari 754 sampel sulit merinci mana saja yang termasuk kategori sedang, berat, atautanpa gejala.
Selain itu, dalam paparannya, TNI AD juga menyatakan pasien diambil dari RS Unair, RS Polri Jakarta, dan Pusat Isolasi Rusunawa, selain dari klaster Secapa.
Di Majalah Farmasetika (2019), jurnal farmasi terbitan Universitas Padjadjaran, dalam artikel berjudul “penelitian”, Hairunnisa menjelaskan tahap-tahap yang seharusnya dilakukan untuk menghasilkan satu temuan obat orisinal. Ada enam tahapan yang harus dilewati sebelum akhirnya bisa memperoleh izin edar.
Secara ringkas tahapannya seperti ini: Seleksi target kerja obat – penentuan senyawa – memprediksi kinerja senyawa – pengujian pra klinik (in vitro) dan uji klinik (in vivo)untuk melihat respons obat – registrasi. Tahapan terakhir adalah mendapatkan izin edar. Di Indonesia, izin ini diterbitkan oleh Badan Pengawas Obat dan Makanan (BPOM).
Tahapan ini juga tidak bisa dilalui dengan mudah. Dari sekitar 10 ribu senyawa, biasanya hanya 1 senyawa yang bisa benar-benar menjadi obat dan boleh dikonsumsi oleh pasien.
Contoh kesulitan di tahapan lain adalah saat uji klinik. Ada empat fase dalam uji klinik. Fase I, obat diuji kepada 25-50 orang. Fase II, target meningkat menjadi 100-200 untuk mendalami efek samping. Fase III dilakukan kepada ribuan orang dengan menyertakan hasil-hasil uji praklinik dan klinik. Fase IV adalah pemantauan setelah pemasaran. Dipilih beberapa orang yang berbeda ras, umur, dan lain-lain secara spesifik untuk pendalaman lebih lanjut.
Metode hampir serupa juga dilakukan dalam membuat vaksin. Hal ini disampaikan Indra Rudiansyah, kandidat doktor riset vaksin di Jenner Institute, Universitas Oxford. Dalam pembuatan vaksin, tahapan yang penting adalah menentukan protein untuk kandidat vaksin, kemudian masuk ke tahapan uji klinik.
Waktu yang diperlukan tidak singkat. Paling cepat, menurut Indra, adalah lima tahun. Dalam situasi pandemi seperti ini pun waktu yang dibutuhkan mencapai 18 bulan. Ini pun hanya untuk masuk dalam tahap uji klinik fase III.
Sampai sekarang, pemerintah Indonesia saja secara resmi tak berani mengklaim sudah berhasil membuat vaksin. Perkembangan terakhir, Ketua Pelaksana Komite Penanganan COVID-19 dan Pemulihan Ekonomi Nasional (KPCPEN) Erick Thohir sibuk mengadakan kerja sama dengan berbagai lembaga untuk bisa mencari dan menyediakan vaksin. Selain Sinovac dan Kimia Farma, Indonesia juga menjajaki kerja sama dengan Genexine, CanSino, dan AstraZeneca, serta perusahaan farmasi lainnya seperti Pfizer, Johnson & Johnson, dan Novafax. Diharapkan, begitu ada vaksin dari manapun, Indonesia akan kebagian.
Peneliti dan anggota The Cochrane Collaboration, Teguh Haryo Sasongko, dalam tulisannya di Conversation, juga meragukan obat yang dihasilkan TNI AD-BIN-Unair melewati tahapan yang matang dan terjamin hasilnya.
Dia mencatat setidaknya ada 7 alasan mengapa campuran obat baru itu (layak) ditolak oleh BPOM untuk diedarkan.
Pertama, informasi dasar uji klinik tidak dijelaskan secara memadai. BPOM sendiri sudah mengatakan bahwa tidak ada keterwakilan keberagaman klinik yang mewakili masyarakat Indonesia. Uji klinik yang dilakukan juga tidak mencatat dengan detail berapa dosis masing-masing obat dan bagaimana prosedur pemberian obat tersebut.
Kedua, soal pemilihan sampel acak yang tidak jelas. Hal ini juga diragukan oleh BPOM.
Ketiga, tidak adanya penjelasan metode allocation concealment. Maksudnya adalah petugas tidak boleh mengetahui obat apa saja yang diberikan pada pasien. Ini untuk menghindari bias penelitian.
Keempat, penggunaan istilah tersamar ganda yang lagi-lagi tidak dielaborasi pihak mana yang disamarkan.
Kelima, yang kelihatannya cukup berpengaruh banyak, adalah absennya pencatatan nilai karakteristik dasar.
Keenam, tidak ada data atau publikasi uji klinik dan penelitian yang bisa ditelaah oleh peneliti lain.
Dalam pembuatan obat di Indonesia, ada beberapa aturan yang harus ditaati oleh pihak yang berkepentingan. Beberapa di antaranya adalah Peraturan BPOM Nomor 34 tahun 2018 tentang Pedoman Cara Pembuatan Obat yang Baik (CPOB) dan Cara Uji Klinik yang Baik (CUKB). Sedangkan WHO menyatakan uji klinik adalah kewajiban ilmiah, moral, dan etika.
Uji klinik seharusnya dipaparkan secara terbuka dan transparan sehingga bisa disimak dan ditelaah oleh peneliti lain sebelum akhirnya disebarluaskan ke publik. Absennya telaah ini yang akhirnya berandil pada kecacatan ketujuh menurut Teguh: tingkat ketidaktepatan tinggi.
Sedangkan dalam tingkat kepatuhan pada CUKB, Teguh menemukan ada empat poin yang belum sesuai dengan kaidah CUKB, yakni ketiadaan informasi publik atas protokol dan hasil uji klinik; ketidakjelasan pihak-pihak yang terlibat; pencantuman BPOM sebagai kolaborator uji klinik yang menimbulkan dugaan konflik kepentingan; keterlibatan TNI sebagai partisipan uji klinik yang berpengaruh pada prinsip sukarela dalam uji klinik.
Kini, BPOM sudah menolak izin edar untuk obat yang diteliti oleh TNI AD-BIN-Unair tersebut. Faktor terbesar karena uji klinik yang dilakukan tidak valid seperti paparan di atas.
Direktur Lembaga Eijkman Amin Soebandrio menilai dalam situasi pandemi pembuatan obat dan vaksin sebenarnya memang mempercepat beberapa tahapan. Tapi, bagaimanapun juga, penelitian harus benar-benar valid dan tak boleh buru-buru.
“Apalagi obat lebih lama (pembuatannya, daripada vaksin),” kata Amin kepada Tirto hari Jumat (11/9/2020). “Mereka sudah kolaborasi dengan BPOM, tapi ternyata ada yang tidak sesuai.”
Menilik sebagian besar bahan obat yang dicampur oleh TNI AD-BIN-Unair sebenarnya tidak memiliki dasar penelitian yang kuat, Amin menganggap akan lebih baik jika ada jurnal penelitian yang lebih dahulu mereka terbitkan sebagai bentuk transparansi penelitian. Dengan begitu, pembuatan obat itu juga makin valid dan terpercaya.
“Itu bisa saja,” kata Amin. “Itu memudahkan kita (peneliti) untuk melakukan review. Apalagi kalau [diterbitkan] di [jurnal] internasional itu harus memenuhi beberapa syarat lagi.”
Masyarakat, utamanya peneliti, termasuk juga pemerintah, sebaiknya menghindari klaim berlebihan tanpa dasar yang kuat. Sampai sekarang banyak orang di luar sana yang sudah menanti obat atau vaksin COVID-19 dan tak bisa ditolong hanya dengan harapan palsu.
Ini diamini oleh Ian Pranadi, sang relawan. “Iya gitu aja (tidak menjanjikan berlebihan) daripada buru-buru, tapi bohong,” katanya.
Harus Berdasar Riset Matang
Obat maupun vaksin COVID-19 sama-sama penting dan membutuhkan waktu lama. Dalam Permenkes Nomor 30 tahun 2014,”Obat adalah bahan atau paduan baha, termasuk bioogi yang digunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan, dan kontrasepsi, untuk manusia.”
Sedangkan vaksin, menurut Permenkes Nomor 12 tahun 2017 adalah “Produk biologi yang berisi antigen berupa mikroorganisme yang sudah mati atau masih hidup ynag dilemahkan.” Sehingga dari bahan pembuatan saja mereka sudah berbeda. Obat tidak melibatkan mikroorganisme di dalamnya.
Berdasar penelitian Vaccines and Drugs: Characteristics of Their Use to Meet Public Health Goals (2005) yang digagas Amie Batson dan Julie B. Milstien, proses produksi vaksin memang akan lebih kompleks daripada obat.
Epidemiolog dari Universitas Indonesia, Pandu Riono, sebenarnya senang saja kampus seperti Universitas Airlangga ikut andil dalam membuat vaksin atau obat untuk COVID-19. Dia percaya kampus bisa berkontribusi, tapi tetap harus berdasar pada penelitian dan data yang valid.
“Boleh, siapa saja kan boleh [membuat obat COVID-19]. Tapi penelitinya harus kredibel, proposalnya terbuka dan mereka melakukan presentasi di kalangan ilmuwan. Mau Unair, UI, UGM, sama siapa saja. Belum tentu dilakukan universitas ternama pasti betul,” kata Pandu kepada Tirto, Sabtu (12/9/2020).
Kampus harus paham juga soal bagaimana obat-obat yang kabarnya efektif untuk perawatan pasien COVID-19 tidak lagi digunakan oleh WHO. Tanpa publikasi dan penjelasan yang matang, hasil penelitian Unair menjadi sulit untuk dipercaya.
“Setiap klaim ilmiah itu harus dipertanggungjawabkan kepada masyarakat ilmiah dulu,” tegas Pandu lagi. “Harusnya yang jawab itu penelitinya (Unair), bukan sponsornya (TNI AD-BIN). Padahal sponsor itu enggak ngerti apa-apa.”
Kembali pada tulisan Teguh Haryo Sasongko di Conversation, Unair setidaknya harus melakukan publikasi ilmiah terlebih dahulu untuk mendukung penelitiannya. Benar bahwa obat COVID-19 penting, tapi jika dilakukan seperti sebelumnya, mereka hanya akan buang-buang duit.
“Dalam kasus riset Unair, karena tidak memenuhi standar, riset tersebut harus diulang dari awal dan itu artinya butuh dana lagi. Akuntabilitas publik proses ilmiah ini hanya dapat dilakukan melalui proses yang transparan dengan publikasi ilmiah,” catat Teguh.
Namun tidak semua kampus gegabah dalam memublikasikan hasil risetnya. Lima mahasiswa dari Fakultas Kedokteran, Kesehatan Masyarakat dan Keperawatan UGM, Siswanto, Oktarium S. Utama, Agit S. Adisetiadi, Maria E. Pranasakti, dan Mohamad S. Hakim pada Juli 2020 menerbitkan studi kasus berjudulEarly hydroxychloroquine and azithromycin as combined therapy for COVID-19: a case series.
Dalam pemaparan, kelima orang itu menemukan bahwa kombinasi obat hidroksiklorokuin dan azitromisin menunjukkan hasil yang baik bagi kesembuhan pasien penderita COVID-19. Tanpa buru-buru, di bagian kesimpulan, mereka menulis bahwa “studi komprehensif lebih lanjut sangat diperlukan untuk memperjelas pemakain obat ini dalam merawat pasien COVID-19.”
Sebelum mengklaim punya obat COVID-19, studi semacam ini yang mungkin perlu diperbanyak dan dijadikan dasar.
==========
Artikel ini diterbitkan sebagai hasil dari program Hibah Liputan: Mendorong Ekosistem Riset, Mendorong Kebijakan Berbasis Bukti kerja sama Aliansi Jurnalis Independen (AJI) dengan Knowledge Sector Initiative (KSI).
Editor: Ivan Aulia Ahsan
 Masuk tirto.id
Masuk tirto.id


































