tirto.id - Saat ini penelitian serta pengembangan vaksi untuk penanganan COVID-19 terus dilakukan berbagai negara.
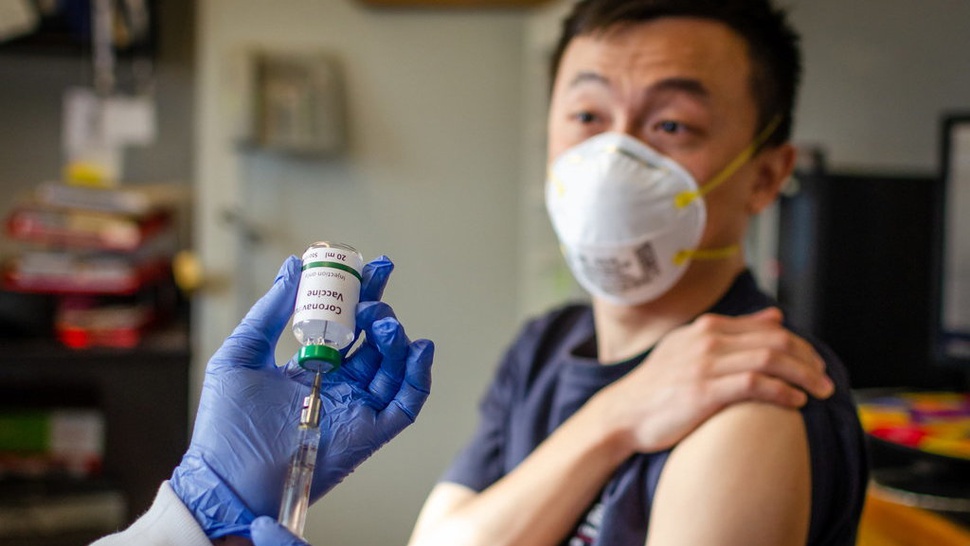
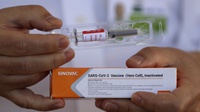
Beberapa penelitian telah memasuki uji klinik fase 3, salah satunya uji klinik vaksin Sinovac.
Uji klinik fase 3 vaksin Sinovac sedang dilakukan di lima negara dengan melibatkan lebih dari 15.000 subjek.
Di Indonesia uji klinik tersebut masih dilaksanakan di center Fakultas Kedokteran Universitas Padjadjaran (FK Unpad).
Guna mendukung hal tersebut, Badan POM sebagai lembaga pemerintah dalam bidang pengawasan Obat dan Makanan ikut memastikan keamanan, kualitas, dan khasiat/manfaat obat temasuk vaksin COVID-19 yang akan digunakan oleh masyarakat.
Khusus untuk vaksin COVID-19, Badan POM berupaya pendampingan uji klinik untuk mendapatkan data khasiat dan keamanan serta pemenuhan data mutu.
Pendampingan uji klinik dimulai sejak pengembangan protokol uji klinik dan inspeksi pelaksanaan uji klinik.
Sedangkan untuk memastikan mutu vaksin dilakukan inspeksi kesiapan fasilitas produksi baik di Cina maupun di Bio Farma.
Dengan upaya pendampingan tersebut diharapkan dapat mempercepat proses penerbitan Emergency Use Authorization (EUA).
Kepala Badan POM RI, Penny K. Lukito menyatakan bahwa uji klinik merupakan tahapan penting dalam penelitian/pengembangan untuk mendapatkan data khasiat, keamanan yang valid untuk mendukung proses registrasi vaksin COVID-19.
Sehingga pelaksanaan uji klinik harus memenuhi aspek saintifik dan menjunjung tinggi etika penelitian sesuai Pedoman Cara Uji Klinik yang Baik (CUKB atau GCP/Good Clinical Practice).
Tim Inspektur Badan POM juga telah melakukan inspeksi pelaksanaan uji klinik vaksin Sinovac di Puskemas Garuda dan Puskesmas Dago, Bandung pada Jumat (16/10/2020) lalu.
Di kedua tempat ini, subjek uji klinik ke-1620 atau subjek terakhir direkrut.
“Sebelumnya, pada 8-9 September 2020, Badan POM telah menginspeksi pelaksanaan uji klinik ke seluruh center uji klinik. Hasil inspeksi menunjukkan tidak ada temuan yang bersifat kritikal,” kata Kepala Badan POM melalui keterangan yang diterima redaksi Tirto.
“Tindakan perbaikan dan pencegahan terhadap temuan-temuan hasil inspeksi sebelumnya telah kami terima. Diharapkan tindakan perbaikan ini dapat menjadi upaya peningkatan kualitas pelaksanaan uji klinik,” lanjutnya.
Inspeksi uji klinik merupakan salah satu pengawalan Badan POM dalam pelaksanaan uji klinik untuk memastikan uji klinik dilaksanakan sesuai dengan protokol yang telah disetujui dan standard Cara Uji Klinik yang Baik.
Sebelumnya Badan POM juga telah memberikan Persetujuan Pelaksanaan Uji Klinik (PPUK) untuk protokol uji klinik.
Uji klinik vaksin Sinovac saat ini telah memasuki tahapan rekrutmen subjek terakhir di Indonesia. Tahap berikutnya adalah vaksinasi kedua serta pengamatan efikasi/khasiat dan keamanan vaksin.
Badan POM mengapresiasi kerja keras semua Tim Penelitian yang dikoordinir oleh Prof. Kusnandi dan Sponsor Bio Farma, sehingga pelaksanaan uji klinik berjalan sesuai dengan timeline yang direncanakan.
“Penelitian ini telah berjalan sesuai dengan protokol yang telah disetujui. Sejauh ini tidak ditemukan adanya reaksi yang berlebihan atau Serious Adverse Event, hanya reaksi ringan seperti umumnya pemberian imunisasi,” jelas Kepala Badan POM.
Selanjutnya Badan POM akan melakukan monitoring secara berkala untuk mendapatkan data khasiat dan keamanan vaksin secara lengkap yang diperlukan dalam pemberian Izin Penggunaan dalam Kondisi Darurat (Emergency Use Authorization).
Badan POM berharap agar Peneliti dan PT. Biofarma sebagai sponsor senantiasa memenuhi semua ketentuan dalam pelaksanaan uji klinik vaksin COVID-19 ini.
Sehingga kemanfaatan hasil uji klinik ini dapat menjadi dasar keputusan yang baik untuk kepentingan kesehatan masyarakat secara luas.
-----------------------------------
Artikel ini terbit atas kerja sama Tirto.id dengan Badan Penanggulangan Bencana Nasional (BNPB).
Editor: Agung DH