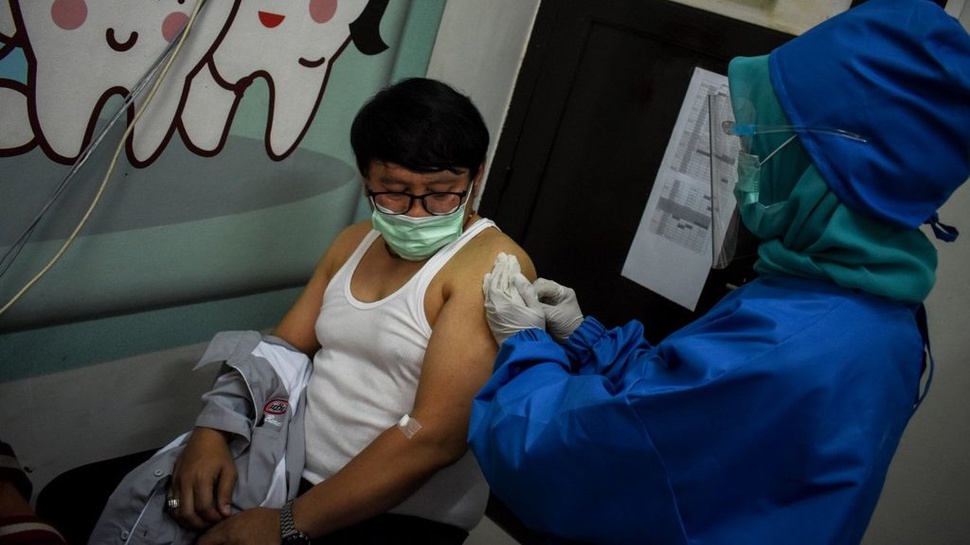
tirto.id - Ketua Tim Penanganan Covid-19 dan Pemulihan Ekonomi Nasional (PC-PEN), Menko Perekonomian Airlangga Hartarto menyampaikan perkembangan terbaru proses upaya penyediaan vaksin Covid-19 untuk kebutuhan Indonesia, hari ini. Dia mengatakan jutaan dosis vaksin Covid-19 rencananya masuk ke Indonesia pada Desember 2020 mendatang.
"Dari Sinovac, akan ada dalam bentuk [vaksin] jadi, sekitar 3 juta [dosis]. Dan, itu akan masuk ke Indonesia secara bertahap," kata Airlangga dalam acara dialog di Media Center Satgas Covid-19, Jakarta, yang disiarkan akun Youtube BNPB pada Selasa (27/10/2020).
Selain mengirim vaksin dalam bentuk jadi, kata Airlangga, Sinovac juga akan mengirimkan bahan baku kepada Bio Farma (BUMN). Jumlah bahan baku vaksin Covid-19 kiriman dari Sinovac tersebut setara dengan 15 juta dosis.
Sinovac merupakan perusahaan farmasi asal Tiongkok. Perusahaan itu kini sedang menuntaskan proses uji klinis tahap 3 vaksin Covid-19 di beberapa negara.
Indonesia merupakan salah satu lokasi uji klinis vaksin Covid-19 buatan Sinovac. Pelaksanaan uji klinis tahap 3 di tanah air dilakukan melalui kerja sama Sinovac dengan Bio Farma.
Kata Airlangga, hasil uji klinis vaksin Sinovac di Bandung, dalam bentuk laporan sementara, akan dievaluasi pada minggu pertama Desember 2020.
Pengunaan Vaksin Covid-19 Harus atas Izin BPOM
Airlangga menegaskan, pengadaan vaksin buatan Sinovac tetap harus melalui proses verifikasi dari Badan Pengawas Obat dan Makanan (BPOM) RI. Setelah ada izin BPOM, vaksin Sinovac baru dapat digunakan di Indonesia.
"Vaksin, pintunya di BPOM. [....] Kuncinya ada di BPOM," ujar Airlangga.
Untuk mendapat izin berupa emergency use authorization (UEA) dari BPOM, vaksin buatan Sinovac harus memenuhi sejumlah persyaratan terkait keamanan penggunaannya, serta memenuhi semua prosedur uji klinis.
Airlangga menambahkan BPOM akan melakukan evaluasi dan menganalisis laporan hasil uji klinis vaksin Sinovac, termasuk dari negara-negara lain. Kata dia, BPOM sudah mengirimkan tim untuk melihat proses pembuatan vaksin di Tiongkok.
Tim kiriman BPOM juga mengunjungi sejumlah negara lain, termasuk Inggris, untuk melihat lokasi produksi vaksin-vaksin lainnya.
"Jika seluruh syarat terpenuhi [ada izin dari BPOM], baru dilakukan imunisasi dengan perencanaan yang matang," ujar Airlangga.
"Ini akan bisa dimulai, setelah BPOM sudah mengeluarkan emergency use authorization."
Pada forum yang sama, Airlangga juga mengklarifikasi kabar Indonesia batal memesan vaksin dari AstraZeneca. Menurut dia, pemerintah RI belum mengambil keputusan apa pun.
"Berita itu tidak sepenuhnya benar. Belum diputuskan," ujar dia.
Airlangga menjelaskan, sampai sekarang, pemerintah masih menganggap AstraZeneca masih jadi salah satu kandidat yang dipertimbangkan akan menyuplai kebutuhan vaksin corona di tanah air.
Di antara alasannya, kata dia, harga vaksin AstraZeneca mendekati harga publik dan perusahaan asal Inggris tersebut bisa menyediakan vaksin dalam jumlah besar. Namun, AstraZeneca tidak bisa menyediakan vaksin dalam waktu dekat.
"Baru bisa masuk pada kuartal kedua 2021. Oleh karena itu, terhadap vaksin dari AstraZeneca dan Novavac dan lainnya, tetap dikaji," terang Airlangga.
Perkembangan Riset Vaksin Merah Putih
Saat hadir dalam acara yang sama di Media Center Satgas Covid-19, Menteri Riset dan Teknologi, Bambang Brodjonegoro mengatakan proses pengembangan vaksin virus corona oleh para peneliti di Indonesia juga masih terus berjalan.
Biasa disebut vaksin merah putih, vaksin Covid-19 yang dikembangkan para peneliti Indonesia ini dibuat berdasarkan isolat virus corona yang bertransmisi di tanah air. Jika berhasil dikembangkan, vaksin merah putih akan diproduksi di Indonesia.
Kata Bambang, terdapat enam institusi yang mengembangkan vaksin merah putih, yakni Lembaga Biologi Molekuler Eijkman, LIPI, Universitas Indonesia, ITB, UGM, dan Universitas Ailarngga.
"Enam institusi ini menggunakan platform pengembangan vaksin Covid-19 yang beda-beda," ujar dia.
Oleh karena itu, kata Bambang, jika enam institusi tersebut berhasil mengembangkan bibit vaksin Covid-19 yang efektif, Indonesia akan memiliki enam jenis vaksin penangkal virus corona.
Penggunaan platform yang berbeda-beda tersebut tergantung dengan teknologi yang dikuasai oleh masing-masing institusi. Dia mencontohkan Lembaga Biologi Molekuler Eijkman memakai platform sub-unit protein recombinant untuk mengembangkan vaksin Covid-19.
"Saat ini keenam institusi itu bekerja masing-masing, tetapi akhirnya mereka akan menghasilkan vaksin Covid-19 dan pemerintah memfasilitasi produksinya," dia menambahkan.
Bibit vaksin yang dikembangkan enam institusi tersebut akan diserahkan kepada Bio Farma, untuk kemudian diproduksi. "Biofarma yang akan membentuk konsorsium bersama perusahaan swasta," ujar Bambang.
Riset Vaksin Eijkman Diprediksi Paling Cepat
Bambang Brodjonegoro memperkirakan pengembangan vaksin merah putih di Lembaga Eijkman, akan menunjukkan hasil paling cepat di antara 6 institusi yang melakukan riset serupa. Lembaga tersebut sekarang sudah menyiapkan proses uji bibit vaksin Covid-19 ke hewan.
"Prosesnya di bulan Oktober ini mereka mempersiapkan uji vaksin ke hewan, yang diharapkan bisa selesai dengan hasil memuaskan pada akhir 2020," kata Bambang.
Jika hasil pengujian ke hewan menunjukkan hasil sesuai rencana, Eijkman akan menyerahkan bibit vaksinnya kepada Bio Farma. BUMN tersebut lalu akan memproduksi vaksin dalam skala kecil buat digunakan dalam proses uji klinis.
"Semua prosedur akan diikuti, uji klinis tahap 1, 2, hingga 3. Kemudian, BPOM akan memutuskan apakah vaksin itu sudah bisa digunakan secara massal atau tidak," tambah Bambang.
Uji klinis vaksin, ujar dia, dilakukan untuk memastikan keamanan dan efektivitasnya. Namun, dia menambahkan, syarat paling utama agar sebuah vaksin lolos uji klinis adalah harus aman, serta terbukti tidak menimbulkan gangguan kesehatan serius kepada manusia.
Bambang juga mengatakan Bio Farma kini sedang berupaya meningkatkan kapasitas produksinya, dari 100 juta dosis vaksin pada tahun ini, menjadi 250 juta dosis pada 2021. Bio Farma juga akan menjalin kerja sama dengan tiga perusahaan swasta untuk pengembangan vaksin.
Apabila kerja sama ini terealisasi, Bambang optimistis kapasitas produksi vaksin Bio Farma bakal mencapai 1 miliar dosis per tahun. Kapasitas ini diperlukan karena Indonesia memerlukan banyak jenis vaksin, tidak hanya untuk menangkal Covid-19.
Apalagi, kata Bambang: "Ada kemungkinan, daya tahan tubuh tidak bisa seumur hidup dari vaksin Covid-19. Kemungkinan ada kebutuhan revaksinasi [Covid-19].
-----------------
Artikel ini diterbitkan atas kerja sama Tirto.id dengan Badan Nasional Penanggulangan Bencana (BNPB).
Editor: Agung DH